
园艺学报 ›› 2024, Vol. 51 ›› Issue (2): 295-308.doi: 10.16420/j.issn.0513-353x.2023-0816
仲钊江1, 吴震1, 周蓉1, 朱为民2, 杨学东2, 于筱薇1, 徐艳1, 高扬杨1, 蒋芳玲1,*( )
)
收稿日期:2023-10-18
修回日期:2023-12-10
出版日期:2024-02-25
发布日期:2024-02-26
通讯作者:
基金资助:
ZHONG Zhaojiang1, WU Zhen1, ZHOU Rong1, ZHU Weimin2, YANG Xuedong2, YU Xiaowei1, XU Yan1, GAO Yangyang1, JIANG Fangling1,*( )
)
Received:2023-10-18
Revised:2023-12-10
Published:2024-02-25
Online:2024-02-26
摘要:
以裂果率差异极显著的番茄为材料,分析了SlPL(Solyc03g111690)基因的表达差异,进一步利用基因遗传转化对其进行功能验证。结果表明,SlPL在易裂番茄‘NT189’中的表达量显著高于耐裂番茄‘NT91’;在番茄果实中的表达量显著高于根、茎、叶、花等器官,且在果实转色期和红熟期表达量较高;通过灌水处理和ABA处理诱导果实开裂,发现在相同处理时期,易裂果材料果实中SlPL表达量总体显著高于耐裂果材料。通过遗传转化获得SlPL过表达(OEPL)和敲除(pl)的株系,与野生型相比,OEPL更易裂果,且果实硬度显著降低,pl果实硬度升高。OEPL果实中原果胶含量显著低于野生型,水溶性果胶含量显著高于野生型,pl果实中原果胶和总果胶含量显著高于野生型;OEPL果实中果胶裂解酶活性显著高于野生型,pl果实中果胶裂解酶活性显著低于野生型。基因表达分析发现,OEPL果实中细胞壁代谢相关基因SlPG2、SlPME2.1、SlCel2、SlGH9C5和乙烯合成途径相关基因SlACS4、SlACO1的相对表达量显著高于野生型,pl果实中则相反。pl果实中乙烯响应因子SlERF2的相对表达量显著高于野生型。果皮显微结构观察发现,与野生型相比,OEPL表皮层细胞和薄壁细胞排列稀疏,而pl果皮细胞排列更为紧密。
仲钊江, 吴震, 周蓉, 朱为民, 杨学东, 于筱薇, 徐艳, 高扬杨, 蒋芳玲. 番茄果胶裂解酶基因SlPL参与调控裂果机制研究[J]. 园艺学报, 2024, 51(2): 295-308.
ZHONG Zhaojiang, WU Zhen, ZHOU Rong, ZHU Weimin, YANG Xuedong, YU Xiaowei, XU Yan, GAO Yangyang, JIANG Fangling. Study on the Regulatory Mechanism of SlPL Gene Affecting Tomato Fruit Cracking[J]. Acta Horticulturae Sinica, 2024, 51(2): 295-308.
| 用途 Purpose | 名称 Name | 序列(5′-3′) Sequence |
|---|---|---|
| 基因克隆引物 Primer for genes clone | pbi121-SlPL-F | gagaacacgggggactctagaATGGGCACTTCCTCTGTTTTTC |
| pbi121-SlPL-R | ataagggactgaccacccgggGCAACGAGAACCCTTTTTACAGTT | |
| 扩增引物 Amplification primers | CRISPR-SlPL-F | ACGAAGGAACAAGGGACCCA |
| CRISPR-SlPL-R | CGGGTGGAGAACTGTTTCGG | |
| 测序引物 Sequencing primers | CRISPR-SlPL-F | CAGATAGGAACAAGGAGT |
| CRISPR-SlPL-R | GGTGGAAATGCTATGGTG | |
| 35S-F | TCCCACTGAATCAAAGGC | |
| qPCR引物 Primer for qPCR | Actin-F | CTCTACATACTTGAGAGGTGCC |
| Actin-R | AGACGAGGAGAAAACATCACAA | |
| SlPL-F | GGAAATCCAATCGACGATTGTT | |
| SlPL-R | CGTTTTTCCCAAATCCAATTGC | |
| SlCel2-F | TATCAAATGGCGTAGAGACTCC | |
| SlCel2-R | ACATTATCTCCGGCATCGTAAT | |
| SlPG2-F | CCAAAGGAATAGTATTCTCCTTCTC | |
| SlPG2-R | GTTTTTCCATCACCCTTAGCTC | |
| SlPME2.1-F | ATGCTACCATCATTACTGGGAG | |
| SlPME2.1-R | GATAAGCATCGATACGACAACG | |
| SlGH9C2-F | CCAGAAGTACTACCGATCTGTC | |
| SlGH9C2-R | TCAGTCATAGACCAACCAGTTC | |
| SlACO1-F | CATACAGACGCAGGAGGCATCA | |
| SlACO1-R | TAGAGTGGCGCATGGGAGGAA | |
| SlACS4-F | CTCCTCAAATGGGGAGTACG | |
| SlACS4-R | TTTTGTTTGCTCGCACTACG | |
| SlERF2-F | CGACCTATGGCCGACTGATT | |
| SlERF2-R | GGTCACGAATTTCAGCAGCC |
表1 本研究中所用的PCR引物
Table 1 PCR primers used in this study
| 用途 Purpose | 名称 Name | 序列(5′-3′) Sequence |
|---|---|---|
| 基因克隆引物 Primer for genes clone | pbi121-SlPL-F | gagaacacgggggactctagaATGGGCACTTCCTCTGTTTTTC |
| pbi121-SlPL-R | ataagggactgaccacccgggGCAACGAGAACCCTTTTTACAGTT | |
| 扩增引物 Amplification primers | CRISPR-SlPL-F | ACGAAGGAACAAGGGACCCA |
| CRISPR-SlPL-R | CGGGTGGAGAACTGTTTCGG | |
| 测序引物 Sequencing primers | CRISPR-SlPL-F | CAGATAGGAACAAGGAGT |
| CRISPR-SlPL-R | GGTGGAAATGCTATGGTG | |
| 35S-F | TCCCACTGAATCAAAGGC | |
| qPCR引物 Primer for qPCR | Actin-F | CTCTACATACTTGAGAGGTGCC |
| Actin-R | AGACGAGGAGAAAACATCACAA | |
| SlPL-F | GGAAATCCAATCGACGATTGTT | |
| SlPL-R | CGTTTTTCCCAAATCCAATTGC | |
| SlCel2-F | TATCAAATGGCGTAGAGACTCC | |
| SlCel2-R | ACATTATCTCCGGCATCGTAAT | |
| SlPG2-F | CCAAAGGAATAGTATTCTCCTTCTC | |
| SlPG2-R | GTTTTTCCATCACCCTTAGCTC | |
| SlPME2.1-F | ATGCTACCATCATTACTGGGAG | |
| SlPME2.1-R | GATAAGCATCGATACGACAACG | |
| SlGH9C2-F | CCAGAAGTACTACCGATCTGTC | |
| SlGH9C2-R | TCAGTCATAGACCAACCAGTTC | |
| SlACO1-F | CATACAGACGCAGGAGGCATCA | |
| SlACO1-R | TAGAGTGGCGCATGGGAGGAA | |
| SlACS4-F | CTCCTCAAATGGGGAGTACG | |
| SlACS4-R | TTTTGTTTGCTCGCACTACG | |
| SlERF2-F | CGACCTATGGCCGACTGATT | |
| SlERF2-R | GGTCACGAATTTCAGCAGCC |
| 用途 Purpose | 基础培 养基 Culture medium | 蔗糖/ (g · L-1) Sucrose | 琼脂粉/ (g · L-1) Agaric | 反式玉米素/ (mg · L -1) trans-ZT | IAA/ (mg · L -1) | IBA /(mg · L -1) | AS / (mg · L -1) | 特美汀/ (mg · L -1)Trimethoprim | 卡那霉素/ (mg · L -1)Kanamycin |
|---|---|---|---|---|---|---|---|---|---|
| 播种 Seeding | 1/2MS | 30 | 7.5 | 0 | 0 | 0 | 0 | 0 | 0 |
| 预培养 Pre-culture | MS | 30 | 9 | 2 | 0.1 | 0 | 0 | 0 | 0 |
| 悬浮培养 Slave culture | MS | 30 | 0 | 0 | 0 | 0 | 100 | 0 | 0 |
| 共培养 Co-culture | MS | 30 | 9 | 2 | 0.1 | 0 | 100 | 0 | 0 |
| 筛选培养1 Screen 1 | MS | 30 | 9 | 2 | 0.1 | 0 | 0 | 200 | 50 |
| 筛选培养2 Screen 2 | MS | 30 | 9 | 0.2 | 0.1 | 0 | 0 | 400 | 50 |
| 生根 Rooting | 1/2MS | 30 | 7.5 | 0 | 0 | 2 | 0 | 0 | 50 |
表2 番茄遗传转化过程中使用的培养基配方
Table 2 Formulation of media used in the genetic transformation of tomato
| 用途 Purpose | 基础培 养基 Culture medium | 蔗糖/ (g · L-1) Sucrose | 琼脂粉/ (g · L-1) Agaric | 反式玉米素/ (mg · L -1) trans-ZT | IAA/ (mg · L -1) | IBA /(mg · L -1) | AS / (mg · L -1) | 特美汀/ (mg · L -1)Trimethoprim | 卡那霉素/ (mg · L -1)Kanamycin |
|---|---|---|---|---|---|---|---|---|---|
| 播种 Seeding | 1/2MS | 30 | 7.5 | 0 | 0 | 0 | 0 | 0 | 0 |
| 预培养 Pre-culture | MS | 30 | 9 | 2 | 0.1 | 0 | 0 | 0 | 0 |
| 悬浮培养 Slave culture | MS | 30 | 0 | 0 | 0 | 0 | 100 | 0 | 0 |
| 共培养 Co-culture | MS | 30 | 9 | 2 | 0.1 | 0 | 100 | 0 | 0 |
| 筛选培养1 Screen 1 | MS | 30 | 9 | 2 | 0.1 | 0 | 0 | 200 | 50 |
| 筛选培养2 Screen 2 | MS | 30 | 9 | 0.2 | 0.1 | 0 | 0 | 400 | 50 |
| 生根 Rooting | 1/2MS | 30 | 7.5 | 0 | 0 | 2 | 0 | 0 | 50 |

图2 耐裂果番茄‘NT91’和易裂果番茄‘NT189’SlPL的表达模式 使用SPSS-Statistics(版本25.0,IBM,美国)进行单因素方差分析,不同字母表示样品间差异显著(P < 0.05)。下同。
Fig. 2 Expression patterns of SlPL in crack-resistant tomato‘NT91’and crack-susceptible tomato‘NT189’ One-way ANOVA was performed using SPSS-statistics(version 25.0,IBM,USA),with different letters indicating significant differences between samples(P < 0.05). The same below.

图3 番茄野生型(WT)‘Micro Tom’、SlPL过表达(OEPL)和敲除(pl)株系的表型和果实横径及硬度
Fig. 3 Phenotypes and fruit diameter across and firmness of wild-type(WT)tomato‘Micro Tom’,SlPL overexpression(OEPL)and knockout(pl)lines

图4 番茄野生型(WT)‘Micro Tom’、SlPL过表达(OEPL)和敲除(pl)株系果实果胶含量及果胶裂解酶活性
Fig. 4 Fruit pectin content and pectin cleavage enzyme activity of wild-type(WT)tomato‘Micro Tom’,SlPL overexpression(OEPL)and knockout(pl)lines
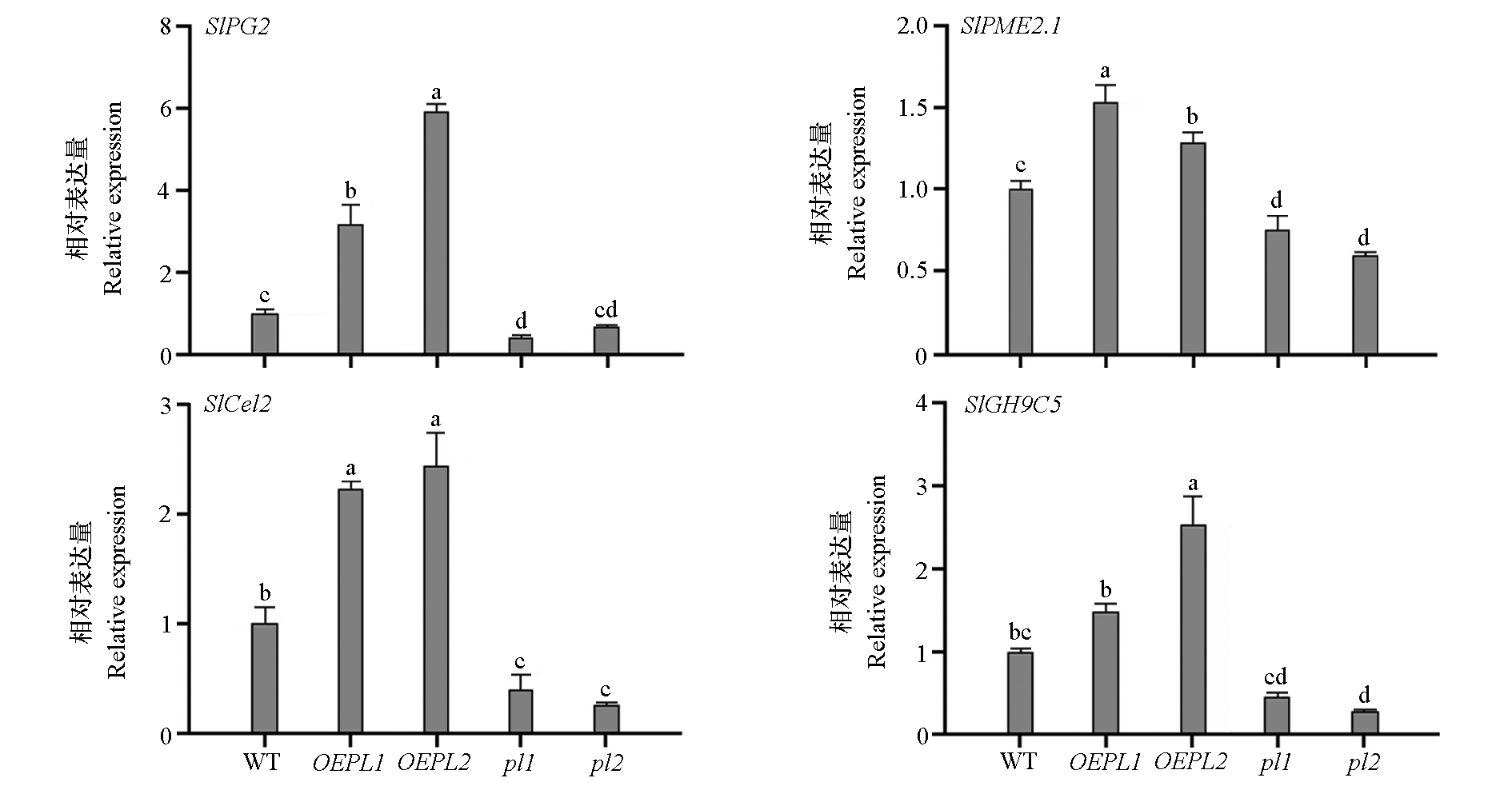
图5 番茄野生型(WT)‘Micro Tom’、SlPL过表达(OEPL)和敲除(pl)株系果实中细胞壁代谢相关基因的相对表达量
Fig. 5 Relative expression of cell wall metabolism-related genes in fruits of wild-type(WT)tomato‘Micro Tom’,SlPL overexpression(OEPL)and knockout(pl)lines
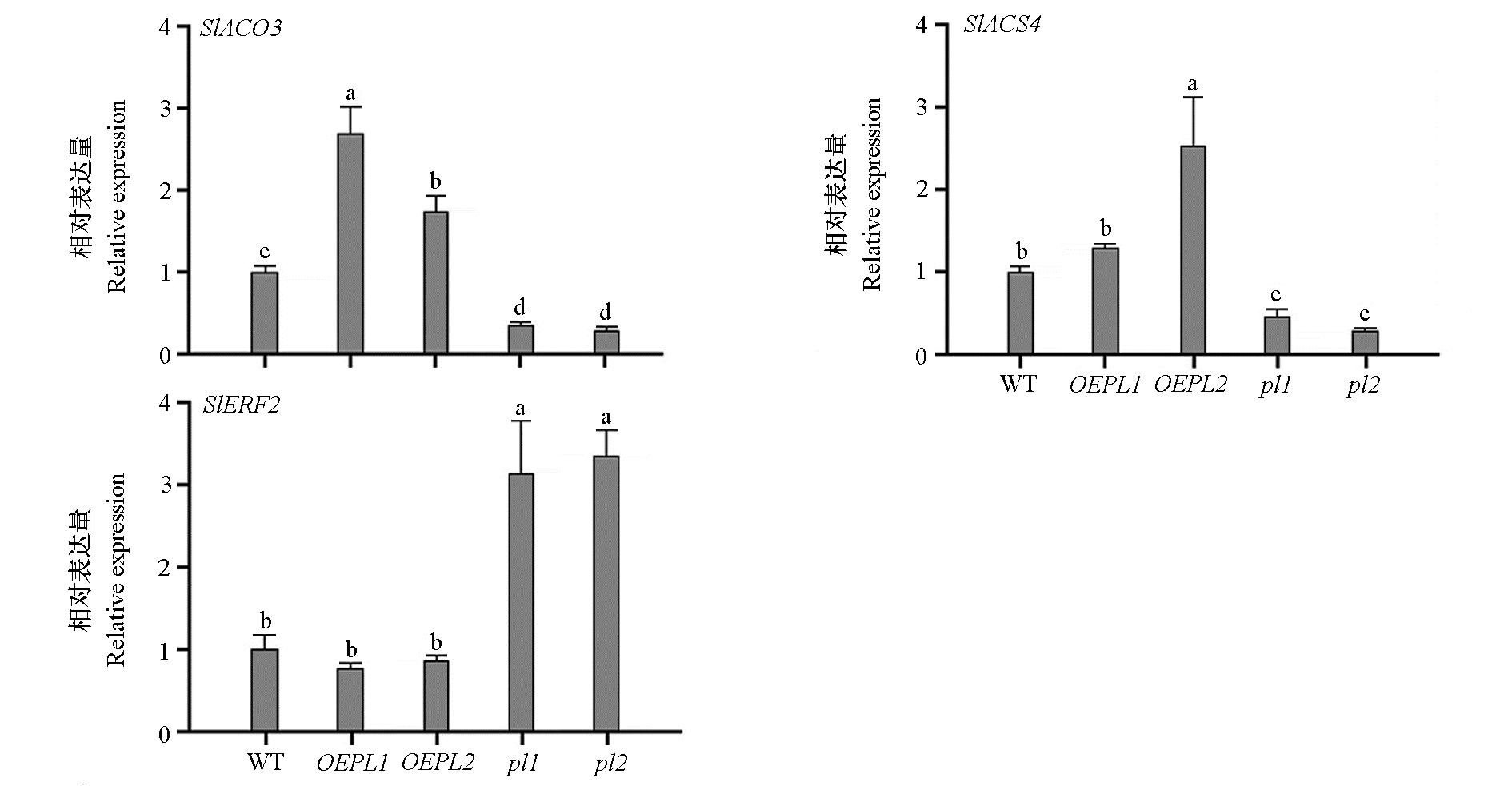
图6 番茄野生型(WT)‘Micro Tom’、SlPL过表达(OEPL)和敲除(pl)株系果实中乙烯合成相关基因和乙烯响应因子的相对表达量
Fig. 6 Relative expression of ethylene synthesis-related genes and ethylene response factors in fruits of wild-type(WT)tomato‘Micro Tom’,SlPL overexpression(OEPL)and knockout(pl)lines
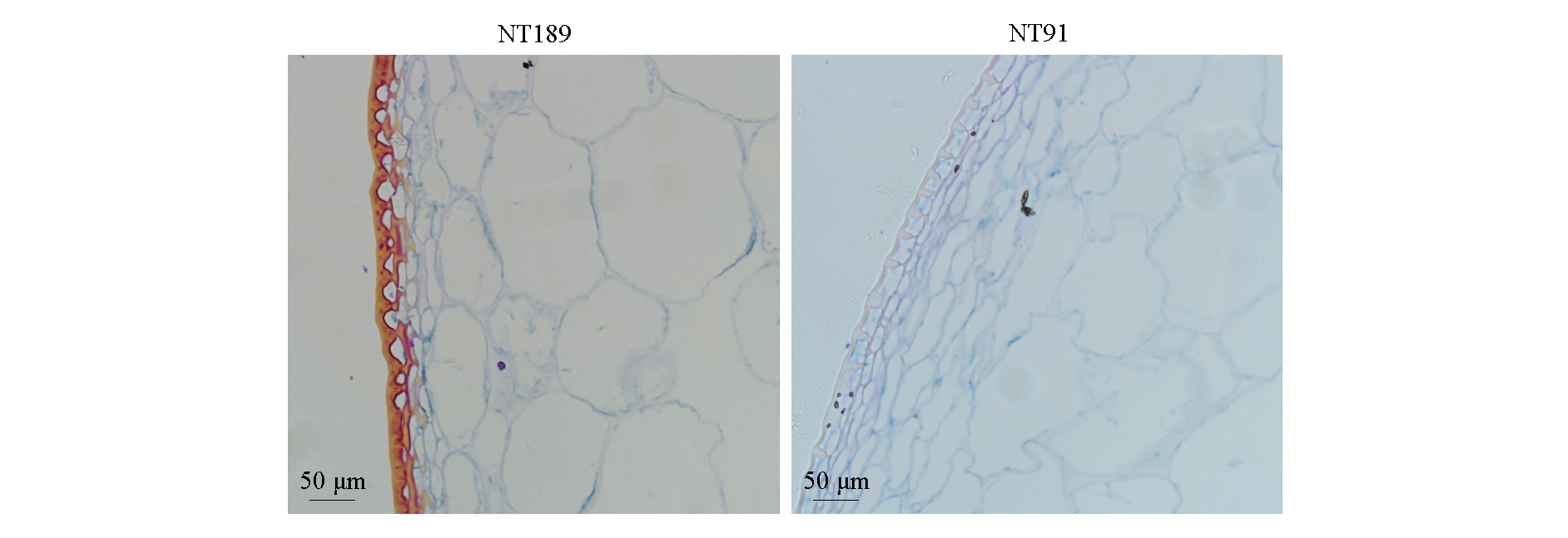
图7 耐裂果番茄‘NT91’和易裂果番茄‘NT189’果皮横切面组织结构
Fig. 7 Histological structure of pericarp cross sections of crack-resistant tomato‘NT91’and crack-susceptible tomato‘NT189’

图8 番茄野生型(WT)‘Micro Tom’、SlPL过表达(OEPL)和敲除(pl)株系果实果皮横切面组织结构
Fig. 8 Histological structure of fruit pericarp cross sections of wild-type(WT)tomato‘Micro Tom’,SlPL overexpression(OEPL)and knockout(pl)lines
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
|
曹建康, 姜微波, 赵玉梅. 2007. 果蔬采后生理生化实验指导. 北京: 中国轻工业出版社.
|
|
| [5] |
|
| [6] |
doi: 10.16420/j.issn.0513-353x.2020-1032 |
|
陈斌, 吴震, 文军琴, 林昊维, 于璐, 薛灵姿, 周蓉, 蒋芳玲. 2021. 番茄不规则裂果性状的QTL定位及候选基因分析. 园艺学报, 48 (7):1329-1339.
doi: 10.16420/j.issn.0513-353x.2020-1032 |
|
| [7] |
|
|
陈乐天, 王慧婷, 韩靖鸾, 栾莹. 2019. 植物果胶裂解酶的研究现状及展望. 华南农业大学学报, 40 (5):71-77.
|
|
| [8] |
|
| [9] |
doi: 10.1093/jxb/erq430 pmid: 21282326 |
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
doi: 10.1038/s41438-018-0105-3 pmid: 30729007 |
| [14] |
doi: 10.16420/j.issn.0513-353x.2022-0875 |
|
黄译瑾, 何佳丽, 姜李娜, 曹艳红, 秦嗣军, 吕德国. 2022. 果实脆性变化的生理生化研究进展. 园艺学报, 49 (12):2641-2658.
doi: 10.16420/j.issn.0513-353x.2022-0875 |
|
| [15] |
|
| [16] |
|
| [17] |
|
|
李泓利, 刘港帅, 田慧琴, 傅达奇. 2021. 果实开裂研究进展. 生物工程学报, 37 (8):2737-2752.
|
|
| [18] |
|
|
李会佳. 2016. 番茄裂果性状的遗传分析及QTL定位[硕士论文]. 哈尔滨: 东北农业大学.
|
|
| [19] |
|
|
李敏. 2013. 乙烯调控早熟苹果果实软化和裂果机理的初步研究[硕士论文]. 泰安: 山东农业大学.
|
|
| [20] |
|
| [21] |
|
|
林昊维. 2022. 番茄裂果关键基因筛选和 SlERF2 基因功能验证[硕士论文]. 南京: 南京农业大学.
|
|
| [22] |
|
| [23] |
doi: 10.16420/j.issn.0513-353x.2022-0653 |
|
卢艳清, 林燕金, 卢新坤. 2023. 果皮细胞壁物质代谢及果皮对高温和水分亏缺逆境的响应与‘度尾文旦柚’裂果相关. 园艺学报, 50 (8):1747-1768.
|
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
doi: 10.1093/jxb/erg214 pmid: 12867545 |
| [28] |
|
| [29] |
|
| [30] |
|
|
宋东亮, 沈君辉, 李来庚. 2008. 高等植物细胞壁中纤维素的合成. 植物生理学通讯, 4:791-796.
|
|
| [31] |
|
|
王傲雪, 苗爽, 陈秀玲, 张瑶, 刘佳音. 2019. 不同裂果类型番茄成熟过程果皮组织衰老研究. 东北农业大学学报, 50 (4):19-28.
|
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
|
徐德利, 杨静, 鲍继友, 谢玲. 2013. 淮北地区冬春季设施番茄裂果的主要原因及预防措施. 江苏农业科学, 41 (9):147-148.
|
|
| [36] |
doi: 10.1186/s12870-020-02373-9 pmid: 32293294 |
| [37] |
|
| [38] |
|
| [39] |
|
|
朱玉, 范丽娜, 黄泽军, 杜永臣, 国艳梅, 李君明, 刘磊, 舒金帅, 王孝宣. 2020. 番茄耐裂果基因Cr3a的精细定位. 园艺学报, 47 (2):275-286.
|
|
| [40] |
|
|
朱珍花, 蒋芳玲, 文军琴, 石潇瀑, 吴翠云, 刘敏, 吴震. 2021. 番茄SlGRAS4基因特征分析和耐热功能鉴定. 西北植物学报, 41 (4):539-548.
|
| [1] | 韩荧, 段颖, 牛一杰, 李衍素, 贺超兴, 孙敏涛, 王君, 李强, 陈双臣, 闫妍. 腐殖酸生物降解地膜提高番茄品质的转录代谢机制研究[J]. 园艺学报, 2024, 51(8): 1758-1772. |
| [2] | 龚小雅, 李贤, 周新刚, 吴凤芝. 分蘖洋葱伴生番茄诱导的根际微生物对根结线虫病的影响[J]. 园艺学报, 2024, 51(8): 1913-1926. |
| [3] | 孟思达, 韩磊磊, 相恒佐, 朱美玉, 冯 珍, 叶云珠, 孙美华, 李艳冰, 赵利萍, 谭昌华, 齐明芳, 李天来. 番茄心室数的调控机制研究进展[J]. 园艺学报, 2024, 51(7): 1649-1664. |
| [4] | 马星云, 范冰丽, 唐光彩, 贾芝琪, 李营, 薛东齐, 张世文. DXR调控番茄叶绿体发育、花色与果实着色机制初探[J]. 园艺学报, 2024, 51(6): 1241-1255. |
| [5] | 王佩云, 李子昂, 白杨, 杨萍, 尹承芃, 李传荣, 张馨文, 宋秀华. ‘海黄’牡丹芳樟醇合酶基因PsTPS14的克隆及功能验证[J]. 园艺学报, 2024, 51(6): 1273-1283. |
| [6] | 张文静, 徐大勇, 吴倩琳, 杨佛, 信丙越, 曾昕, 李峰. 拮抗番茄灰霉病的贝莱斯芽孢杆菌XDY66基因组分析[J]. 园艺学报, 2024, 51(6): 1413-1425. |
| [7] | 王永珍, 张剑国, 刘彩虹, 李思蓓, 吕甜甜. 番茄新品种‘圆红212’[J]. 园艺学报, 2024, 51(6): 1435-1436. |
| [8] | 刘泽营, 孙帅, 刘志强, 崔霞, 李仁. 番茄尖果脐突变体的生理特性及其候选基因分析[J]. 园艺学报, 2024, 51(5): 982-992. |
| [9] | 李品, 甘宁, 陈家伟, 项思翔, 沈静漪, 欧阳波, 卢永恩. 番茄自然群体磷利用效率分析及耐低磷种质筛选[J]. 园艺学报, 2024, 51(5): 993-1004. |
| [10] | 杨婷, 席德慧, 夏明, 李佳楠. α-苦瓜素基因提高番茄对烟草花叶病毒抗性的机理研究[J]. 园艺学报, 2024, 51(5): 1126-1136. |
| [11] | 胡志峰, 邵景成, 张莉. 番茄新品种‘陇番15号’[J]. 园艺学报, 2024, 51(4): 917-918. |
| [12] | 刘根忠, 李方曼, 葛平飞, 陶金宝, 张星雨, 叶志彪, 张余洋. 番茄抗坏血酸含量相关QTL定位及候选基因鉴定[J]. 园艺学报, 2024, 51(2): 219-228. |
| [13] | 董舒超, 洪骏, 凌嘉怡, 谢紫欣, 张胜军, 赵丽萍, 宋刘霞, 王银磊, 赵统敏. 番茄抗旱性的全基因组关联分析[J]. 园艺学报, 2024, 51(2): 229-238. |
| [14] | 徐琴, 王嘉颖, 张曼楠, 萧志浩, 郑涵楷, 卢永恩, 王涛涛, 张余洋, 张俊红, 叶志彪, 叶杰. 番茄苗期耐盐相关遗传位点鉴定及分子标记开发[J]. 园艺学报, 2024, 51(2): 239-252. |
| [15] | 杨亮, 刘欢, 马燕勤, 李菊, 王海娥, 周玉洁, 龙海成, 苗明军, 李志, 常伟. 利用CRISPR/Cas9技术创制高番茄红素番茄新材料[J]. 园艺学报, 2024, 51(2): 253-265. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||
版权所有 © 2012 《园艺学报》编辑部 京ICP备10030308号-2 国际联网备案号 11010802023439
编辑部地址: 北京市海淀区中关村南大街12号中国农业科学院蔬菜花卉研究所 邮编: 100081
电话: 010-82109523 E-Mail: yuanyixuebao@126.com
技术支持:北京玛格泰克科技发展有限公司