
园艺学报 ›› 2024, Vol. 51 ›› Issue (2): 253-265.doi: 10.16420/j.issn.0513-353x.2023-0782
杨亮1,2,3,4, 刘欢1,3,4, 马燕勤1,2,3,4, 李菊1,2,3,4, 王海娥1,4, 周玉洁1,3,4, 龙海成1,3,4, 苗明军1,2,3,4, 李志1,2,3,4,*( ), 常伟2,3,4,5,*(
), 常伟2,3,4,5,*( )
)
收稿日期:2023-12-07
修回日期:2024-01-06
出版日期:2024-02-25
发布日期:2024-02-26
通讯作者:
基金资助:
YANG Liang1,2,3,4, LIU Huan1,3,4, MA Yanqin1,2,3,4, LI Ju1,2,3,4, WANG Hai'e1,4, ZHOU Yujie1,3,4, LONG Haicheng1,3,4, MIAO Mingjun1,2,3,4, LI Zhi1,2,3,4,*( ), CHANG Wei2,3,4,5,*(
), CHANG Wei2,3,4,5,*( )
)
Received:2023-12-07
Revised:2024-01-06
Published:2024-02-25
Online:2024-02-26
摘要:
以大果型栽培番茄资源“T048”为材料,利用CRISPR/Cas9技术对滞绿基因SlSGR1进行定向编辑。对19株转基因阳性株系进行靶位点序列分析发现,共有10株发生了编辑事件,编辑效率为52.6%。通过测序分析发现,编辑类型涉及碱基的缺失、插入及替换,多数发生在PAM序列上游3 ~ 4 bp碱基处,同时也发现了两个编辑位点间共565 bp的序列倒位。表型分析发现,T1代纯合编辑株系叶片衰老减缓,果实表现为铁锈色,且番茄红素、叶绿素及β-胡萝卜素含量显著提高。对类胡萝卜素合成关键基因进行分析发现,纯合编辑株系果实中的SGR1表达量显著降低,而PSY1表达量显著提高。结果表明,通过CRISPR/Cas9技术对滞绿基因SlSGR1进行定向编辑可有效提升番茄果实中番茄红素、β-胡萝卜素等类胡萝卜素含量,进而为番茄营养品质育种提供新种质。
杨亮, 刘欢, 马燕勤, 李菊, 王海娥, 周玉洁, 龙海成, 苗明军, 李志, 常伟. 利用CRISPR/Cas9技术创制高番茄红素番茄新材料[J]. 园艺学报, 2024, 51(2): 253-265.
YANG Liang, LIU Huan, MA Yanqin, LI Ju, WANG Hai'e, ZHOU Yujie, LONG Haicheng, MIAO Mingjun, LI Zhi, CHANG Wei. Creating High Lycopene Fruit Using CRISPR/Cas9 Technology in Tomato[J]. Acta Horticulturae Sinica, 2024, 51(2): 253-265.
| 用途 Aim | 引物名称 Primer name | 引物序列(5′-3′) Primer sequence |
|---|---|---|
| 载体构建Construction vector | SGR1-target1-F | ATATATGGTCTCGTTTGAGATGAAGTTGTTGCAGAGGTTTTAGAGCTAGAAATAG |
| SGR1-target2-R | ATTATTGGTCTCGAAACCCAGTGAGTGTTATGCCTTCCAAACTACACTGTTAGATTC | |
| 阳性克隆验证Identification of the positive clones | M13-F | GTAAAACGACGGCCAGT |
| SGR1-target2 | CCAGTGAGTGTTATGCCTT | |
| 转基因株验证Identification of the transformation plants | Cas9-F | AGGTCACGGTTAAGCAGCTC |
| Cas9-R | CCCTTCTGCGTGGTCTGATT | |
| 靶位点检测 Detection target | SGR1-Seqtarget-F | GTTTGATTTGCAGTTGCAAGGTT |
| SGR1-Seqtarget-R | AATGCTGCTTCCACAAACCC | |
| Real-time PCR | SlACTIN-RT-F | GGGATGGAGAAGTTTGGTGGTGG |
| SlACTIN-RT-R | CTTCGACCAAGGGATGGTGTAGC | |
| SGR1-RT-F | GGGTCCACTCAGAGATGCAA | |
| SGR1-RT-R | ACTCACTGGGGGAAAGCAAC | |
| PDS-RT-F | AAGGCGCTGTCTTATCAGGAAA | |
| PDS-RT-R | TAAACTACGCTTGCTTCCGACA | |
| ZDS-RT-F | ACCGTACAACTACGCTACAATGG | |
| ZDS-RT-R | CATCTGGCGTATAGAGGAGATTG | |
| PSY1-RT-F | TATTTGCTGGAAGGGTGACC | |
| PSY1-RT-R | TAGCTGAGCTCAATTCTGTC |
表1 本研究中所使用引物
Table 1 The primers used in this study
| 用途 Aim | 引物名称 Primer name | 引物序列(5′-3′) Primer sequence |
|---|---|---|
| 载体构建Construction vector | SGR1-target1-F | ATATATGGTCTCGTTTGAGATGAAGTTGTTGCAGAGGTTTTAGAGCTAGAAATAG |
| SGR1-target2-R | ATTATTGGTCTCGAAACCCAGTGAGTGTTATGCCTTCCAAACTACACTGTTAGATTC | |
| 阳性克隆验证Identification of the positive clones | M13-F | GTAAAACGACGGCCAGT |
| SGR1-target2 | CCAGTGAGTGTTATGCCTT | |
| 转基因株验证Identification of the transformation plants | Cas9-F | AGGTCACGGTTAAGCAGCTC |
| Cas9-R | CCCTTCTGCGTGGTCTGATT | |
| 靶位点检测 Detection target | SGR1-Seqtarget-F | GTTTGATTTGCAGTTGCAAGGTT |
| SGR1-Seqtarget-R | AATGCTGCTTCCACAAACCC | |
| Real-time PCR | SlACTIN-RT-F | GGGATGGAGAAGTTTGGTGGTGG |
| SlACTIN-RT-R | CTTCGACCAAGGGATGGTGTAGC | |
| SGR1-RT-F | GGGTCCACTCAGAGATGCAA | |
| SGR1-RT-R | ACTCACTGGGGGAAAGCAAC | |
| PDS-RT-F | AAGGCGCTGTCTTATCAGGAAA | |
| PDS-RT-R | TAAACTACGCTTGCTTCCGACA | |
| ZDS-RT-F | ACCGTACAACTACGCTACAATGG | |
| ZDS-RT-R | CATCTGGCGTATAGAGGAGATTG | |
| PSY1-RT-F | TATTTGCTGGAAGGGTGACC | |
| PSY1-RT-R | TAGCTGAGCTCAATTCTGTC |
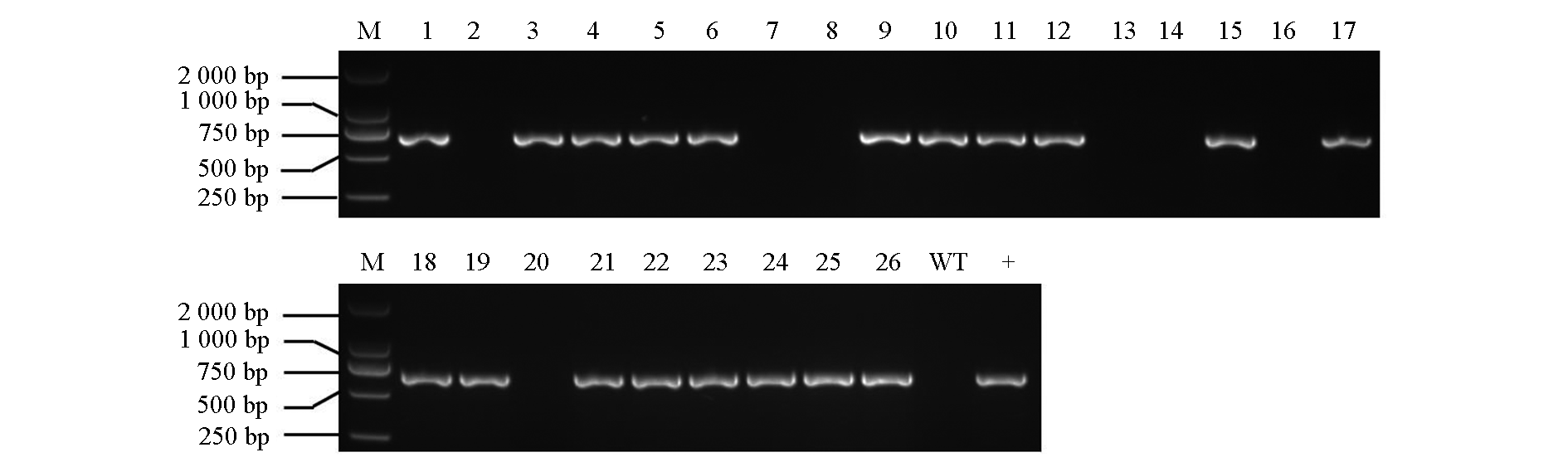
图2 番茄SlSGR1基因编辑T0代阳性株系鉴定 M:DL2000 DNA marker;1 ~ 26:生根株系样本;WT:野生型;+:阳性对照。
Fig. 2 Identification of positive transgenic lines in SlSGR1 edited T0 generation plants M:DL2000 DNA marker;1-26:Rooted plants;WT:Wild type;+:Positive control.

图4 番茄SlSGR1基因编辑T0代10个阳性株系突变序列分析 Ho:纯合突变;He:杂合突变;Bi:双等位突变;Ch:嵌合突变;WT:野生型;d:碱基缺失;i:碱基插入;s:碱基替换。
Fig. 4 Mutation sequence analysis of ten SlSGR1 edited T0 generation plants Ho:Homozygous mutation;He:Heterozygous mutation;Bi:Biallelic mutation;Ch:Chimeric mutation;WT:Wild type;d:Base deletion;i:Base insertion;s:Base substitution.
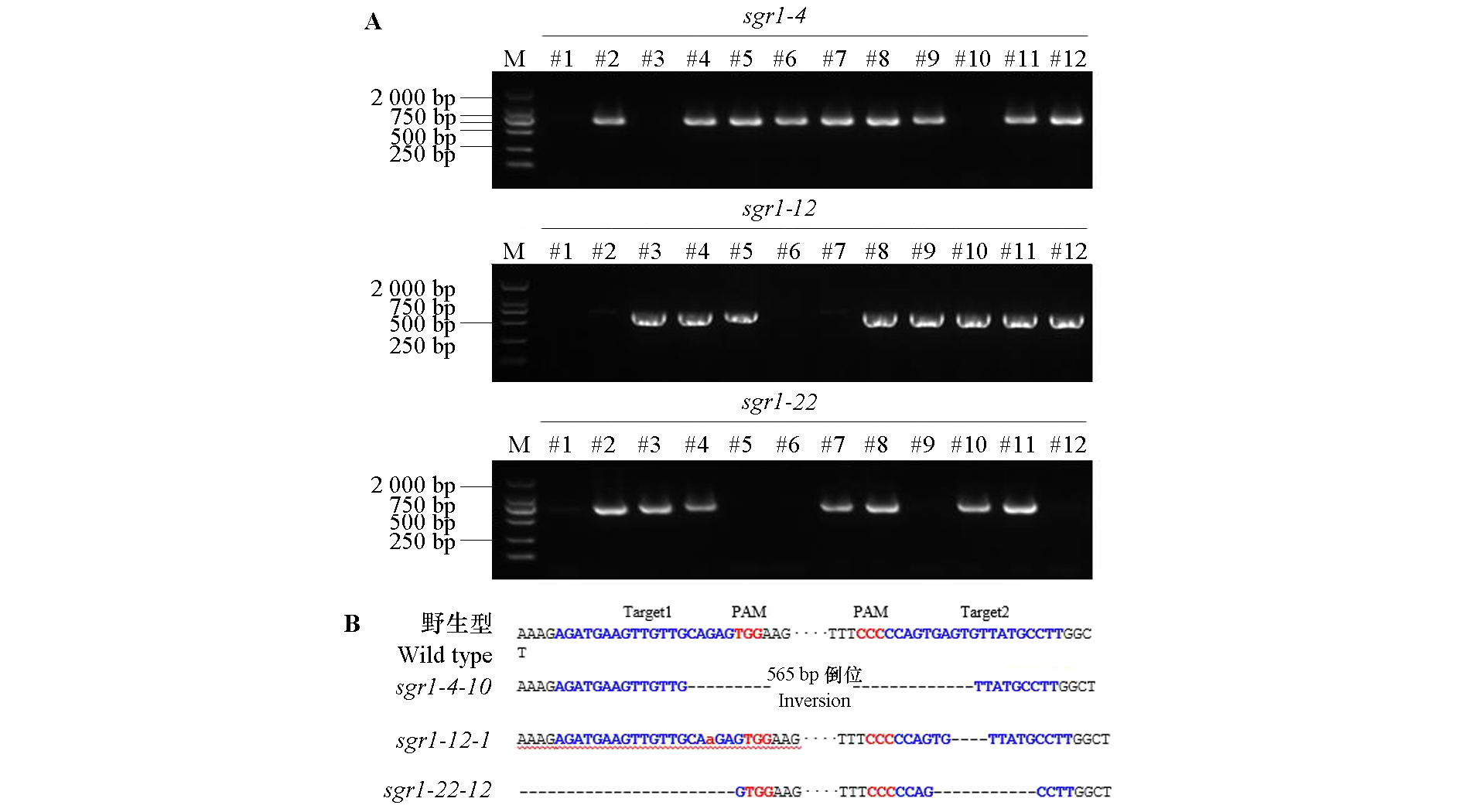
图5 番茄SlSGR1基因编辑株系(sgr1-4、sgr1-12和sgr1-22)的T1代无外源T-DNA纯合材料筛选(A)及靶位点序列分析(B)
Fig. 5 Screening of T1 exogenous T-DNA-free homozygous lines in SlSGR1 edited plants (sgr1-4, sgr1-12 and sgr1-22)(A)and sequence analysis of their target sites(B)

图6 番茄SlSGR1基因编辑株系(sgr1-4-10、sgr1-12-1和sgr1-22-12)叶片和果实的表型
Fig. 6 Phenotypes of leaves and fruits in SlSGR1 edited plants(sgr1-4-10,sgr1-12-1 and sgr1-22-12)
| 基因编辑株系 Genome editing plant | 番茄红素/(μg • g-1) Lycopene | 叶绿素/(μg • g-1) Chlorophyll | β-胡萝卜素/(μg • g-1) β-carotenoids | 抗坏血酸/(μg · g-1) Vitamin C | 可溶性固形物/% Soluble solids | |
|---|---|---|---|---|---|---|
| 野生型Wild type | 53.70 ± 9.54 b | 4.28 ± 1.24 b | 38.44 ± 3.98 b | 251.64 ± 11.58 a | 4.77 ± 0.40 a | |
| sgr1-4-10 | 73.21 ± 9.56 a | 29.60 ± 1.50 a | 53.32 ± 2.74 a | 246.43 ± 17.73 a | 5.13 ± 0.85 a | |
| sgr1-22-12 | 75.08 ± 9.11 a | 37.20 ± 6.30 a | 59.71 ± 1.13 a | 254.73 ± 7.27 a | 4.87 ± 0.15 a | |
表2 番茄SlSGR1基因编辑阳性株系的类胡萝卜素、叶绿素及营养品质
Table 2 Content of carotenoids,chlorophyll and nutritional quality traits in SlSGR1 edited plants
| 基因编辑株系 Genome editing plant | 番茄红素/(μg • g-1) Lycopene | 叶绿素/(μg • g-1) Chlorophyll | β-胡萝卜素/(μg • g-1) β-carotenoids | 抗坏血酸/(μg · g-1) Vitamin C | 可溶性固形物/% Soluble solids | |
|---|---|---|---|---|---|---|
| 野生型Wild type | 53.70 ± 9.54 b | 4.28 ± 1.24 b | 38.44 ± 3.98 b | 251.64 ± 11.58 a | 4.77 ± 0.40 a | |
| sgr1-4-10 | 73.21 ± 9.56 a | 29.60 ± 1.50 a | 53.32 ± 2.74 a | 246.43 ± 17.73 a | 5.13 ± 0.85 a | |
| sgr1-22-12 | 75.08 ± 9.11 a | 37.20 ± 6.30 a | 59.71 ± 1.13 a | 254.73 ± 7.27 a | 4.87 ± 0.15 a | |

图7 番茄SlSGR1基因编辑株系sgr1-4-10和sgr1-22-12果实类胡萝卜素合成途径关键基因的相对表达量 MG:绿熟期;Br:破色期;Br + 4:破色后4 d;Br + 10:破色后10 d。不同小写字母表示同一时期材料间差异显著(P < 0.05)。
Fig. 7 Relative expression of key genes of carotenoid synthesis pathway in four fruit development stages of different genome editing tomato plants MG:Mature green stage;Br:Break stage;Br + 4:Four days after break stage;Br + 10:Ten days after break stage.Columns with different lowercase letters indicate significant differences among lines in the same stage(P < 0.05).
| [1] |
|
| [2] |
|
| [3] |
doi: 10.1126/science.1231143 pmid: 23287718 |
| [4] |
|
| [5] |
|
| [6] |
doi: 10.1105/tpc.105.039966 pmid: 16816137 |
| [7] |
doi: 10.1016/j.cell.2021.01.005 pmid: 33581057 |
| [8] |
doi: 10.1016/j.tplants.2009.01.002 pmid: 19237309 |
| [9] |
doi: 10.1186/s12896-015-0131-2 pmid: 25879861 |
| [10] |
doi: 10.16420/j.issn.0513-353x.2022-0273 |
|
李国斌, 蔡梁玉, 肖立成, 王家发, 张得迪, 张俊红. 2023. 利用CRISPR/Cas9技术创制番茄粉果和无绿肩材料. 园艺学报, 50 (5):985-999.
doi: 10.16420/j.issn.0513-353x.2022-0273 |
|
| [11] |
|
| [12] |
doi: 10.1038/srep21451 pmid: 26891616 |
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
doi: 10.1006/meth.2001.1262 pmid: 11846609 |
| [18] |
doi: 10.1038/s41477-021-01019-4 pmid: 34782773 |
| [19] |
doi: S1674-2052(16)30297-0 pmid: 27932049 |
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
doi: 10.1038/nbt.2650 pmid: 23929338 |
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
doi: 10.16420/j.issn.0513-353x.2022-0339 |
|
杨孟霞, 刘晓林, 曹雪, 魏凯, 宁宇, 杨沛, 李珊珊, 陈紫月, 王孝宣, 国艳梅, 杜永臣, 李君明, 刘磊, 李鑫, 黄泽军. 2023. 番茄CRISPR/Cas9介导的多基因编辑技术体系构建与应用. 园艺学报, 50 (6):1215-1229.
doi: 10.16420/j.issn.0513-353x.2022-0339 |
|
| [35] |
doi: S1673-8527(19)30167-5 pmid: 31734133 |
| [36] |
doi: 10.16420/j.issn.0513-353x.2020-0976 |
|
张爱萍, 刘江娜, 闫建俊, 张西英, 白云凤. 2022. 番茄基因编辑研究进展和前景. 园艺学报, 49 (1):221-232.
doi: 10.16420/j.issn.0513-353x.2020-0976 |
|
| [37] |
doi: 10.1016/j.cj.2016.08.001 |
| [38] |
|
| [39] |
|
|
郑爱红, 张芬, 江敏, 袁巧, 江雷雨, 陈清, 汤浩茹, 孙勃. 2019. 利用CRISPR/Ca9技术靶向编辑芥蓝BoaZDS. 园艺学报, 46 (1):57-64.
doi: 10.16420/j.issn.0513-353x.2018-0426 |
| [1] | 赵佳莹, 曾周婷, 岑欣颖, 施姣淇, 李效贤, 沈晓霞, 俞振明, . 铁皮石斛CCO基因家族鉴定及其在花发育中的表达分析[J]. 园艺学报, 2024, 51(9): 2075-2088. |
| [2] | 韩荧, 段颖, 牛一杰, 李衍素, 贺超兴, 孙敏涛, 王君, 李强, 陈双臣, 闫妍. 腐殖酸生物降解地膜提高番茄品质的转录代谢机制研究[J]. 园艺学报, 2024, 51(8): 1758-1772. |
| [3] | 段敏杰, 李怡斐, 王春萍, 杨小苗, 黄任中, 黄启中, 张世才. 辣椒果实类胡萝卜素调控因子转录组和靶向代谢组分析[J]. 园艺学报, 2024, 51(8): 1773-1791. |
| [4] | 龚小雅, 李贤, 周新刚, 吴凤芝. 分蘖洋葱伴生番茄诱导的根际微生物对根结线虫病的影响[J]. 园艺学报, 2024, 51(8): 1913-1926. |
| [5] | 王晨雨, 刘孟军, 王立新, 刘志国, . CRISPR/Cas9技术研究进展及其在园艺植物中的应用进展[J]. 园艺学报, 2024, 51(7): 1439-1454. |
| [6] | 孟思达, 韩磊磊, 相恒佐, 朱美玉, 冯 珍, 叶云珠, 孙美华, 李艳冰, 赵利萍, 谭昌华, 齐明芳, 李天来. 番茄心室数的调控机制研究进展[J]. 园艺学报, 2024, 51(7): 1649-1664. |
| [7] | 江 睿, 周胜军, 朱育强, 王 欣, 谭继宏, 王华森, 张 鹏, . 瓜类作物CRISPR/Cas9基因编辑技术应用研究进展[J]. 园艺学报, 2024, 51(7): 1683-1694. |
| [8] | 马星云, 范冰丽, 唐光彩, 贾芝琪, 李营, 薛东齐, 张世文. DXR调控番茄叶绿体发育、花色与果实着色机制初探[J]. 园艺学报, 2024, 51(6): 1241-1255. |
| [9] | 张文静, 徐大勇, 吴倩琳, 杨佛, 信丙越, 曾昕, 李峰. 拮抗番茄灰霉病的贝莱斯芽孢杆菌XDY66基因组分析[J]. 园艺学报, 2024, 51(6): 1413-1425. |
| [10] | 王永珍, 张剑国, 刘彩虹, 李思蓓, 吕甜甜. 番茄新品种‘圆红212’[J]. 园艺学报, 2024, 51(6): 1435-1436. |
| [11] | 刘泽营, 孙帅, 刘志强, 崔霞, 李仁. 番茄尖果脐突变体的生理特性及其候选基因分析[J]. 园艺学报, 2024, 51(5): 982-992. |
| [12] | 李品, 甘宁, 陈家伟, 项思翔, 沈静漪, 欧阳波, 卢永恩. 番茄自然群体磷利用效率分析及耐低磷种质筛选[J]. 园艺学报, 2024, 51(5): 993-1004. |
| [13] | 王文娇, 邢军杰, 申成丞, 李斌. 黄瓜蜡质基因CsCER1调控因子CsCOL5的筛选及其功能分析[J]. 园艺学报, 2024, 51(5): 1005-1016. |
| [14] | 杨婷, 席德慧, 夏明, 李佳楠. α-苦瓜素基因提高番茄对烟草花叶病毒抗性的机理研究[J]. 园艺学报, 2024, 51(5): 1126-1136. |
| [15] | 胡志峰, 邵景成, 张莉. 番茄新品种‘陇番15号’[J]. 园艺学报, 2024, 51(4): 917-918. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||
版权所有 © 2012 《园艺学报》编辑部 京ICP备10030308号-2 国际联网备案号 11010802023439
编辑部地址: 北京市海淀区中关村南大街12号中国农业科学院蔬菜花卉研究所 邮编: 100081
电话: 010-82109523 E-Mail: yuanyixuebao@126.com
技术支持:北京玛格泰克科技发展有限公司