
园艺学报 ›› 2025, Vol. 52 ›› Issue (9): 2329-2342.doi: 10.16420/j.issn.0513-353x.2024-0960
朱存兰1,2, 范军亮1,2, 王凯彤1,3, 韦孟1,2, 杨亮1,3, 刘昊天1,3, 司怀军1,2, 张宁1,2,*( )
)
收稿日期:2025-04-18
修回日期:2025-07-21
出版日期:2025-09-25
发布日期:2025-09-24
通讯作者:
基金资助:
ZHU Cunlan1,2, FAN Junliang1,2, WANG Kaitong1,3, WEI Meng1,2, YANG Liang1,3, LIU Haotian1,3, SI Huaijun1,2, ZHANG Ning1,2,*( )
)
Received:2025-04-18
Revised:2025-07-21
Published:2025-09-25
Online:2025-09-24
摘要:
RING DOMAIN LIGASE(RGLG)属于RING型泛素连接酶E3,参与植物生长发育、信号转导与非生物胁迫等进程。为进一步研究StRGLG1基因在马铃薯逆境响应中的功能和调控机制,采用qRT-PCR技术检测马铃薯StRGLG1基因在干旱胁迫下的表达水平;通过遗传转化获得马铃薯StRGLG1过表达植株和干扰表达植株,测定了转基因植株在干旱胁迫前后超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性以及丙二醛(MDA)含量。通过酵母双杂交(Y2H)和双分子荧光互补(BiFC)鉴定并验证了StRGLG1相互作用蛋白。结果表明,干旱胁迫下StRGLG1的过表达植株SOD、POD和CAT等酶活性平均分别上升31.78%、46.87%、51.76%,MDA含量下降23.12%,干扰表达植株与之相反,SOD、POD和CAT平均分别下降15.83%、18.28%、13.78%,MDA含量上升13.30%。证明StRGLG1基因在马铃薯耐旱性调控中发挥了作用。Y2H和BiFC结果发现StRGLG1和StERF53蛋白相互作用。这些结果表明,StRGLG1基因的表达对马铃薯的抗逆性具有一定的作用,研究结果可为StRGLG1调控马铃薯干旱胁迫响应的分子机制提供参考。
朱存兰, 范军亮, 王凯彤, 韦孟, 杨亮, 刘昊天, 司怀军, 张宁. 马铃薯StRGLG1调控干旱胁迫响应的功能研究[J]. 园艺学报, 2025, 52(9): 2329-2342.
ZHU Cunlan, FAN Junliang, WANG Kaitong, WEI Meng, YANG Liang, LIU Haotian, SI Huaijun, ZHANG Ning. Function Analysis ofStRGLG1in Regulating Potato to Drought Stress Response[J]. Acta Horticulturae Sinica, 2025, 52(9): 2329-2342.
| 基因名称/ID Gene name/ID | 引物序列(5′-3′) Primer sequence | 用途 Application | |
|---|---|---|---|
| pCAMBIA1300‐3 5S‐StRGLG1 | F | AGAACACGGGGGACGAGCTCATGGGGAATCAAGAGTCTGC | 载体构建 Construction of vector |
| R | TGCTCACCATGTCGACCTAGCTATATAGTCTTATGCGAGTT | ||
| pEGFP-amiR-StRGLG1 | I miR-s | gaTATGGAATTTACAGTAGCCTAtctctcttttgtattcc | |
| II miR-a | gaTAGGCTACTGTAAATTCCATAtcaaagagaatcaatga | ||
| III miR*s | gaTAAGCTACTGTAATTTCCATTtcacaggtcgtgatatg | ||
| IV miR*a | gaAATGGAAATTACAGTAGCTTAtctacatatatattcct | ||
| A | CTGCAAGGCGATTAAGTTGGGTAAC | ||
| B | CTGTTTCCTGTGTGAAATTGTTATCCGC | ||
| pGBKT7‐StRGLG1 | F | AGGAGGACCTGCATATGATGGGGAATCAAGAGTCTGC | |
| R | GCCGCTGCAGGTCGACCTAGCTATATAGTCTTATGCGAGTT | ||
| pGADT7‐StERF53 | F | GGAGGCCAGTGAATTATGGCAGCTATGGATTTTTGGAA | |
| R | TTCATCTGCAGCTCGTTATAGGGAGGCCCAATCAATTTCA | ||
| pSPYNE-StRGLG1 | F | CACGGGGGACTCTAGATGGGGAATCAAGAGTCTGC | |
| R | TCCATCCCGGGAGCGGCTATATAGTCTTATGCGAGTTTT | ||
| pSPYCE-StERF53 | F | CACGGGGGACTCTAGATGGCAGCTATGGATTTTTGGAA | |
| R | TACATCCCGGGAGCGTAGGGAGGCCCAATCAATTTCATGA | ||
| StRGLG1 | F | ACCACACACGATCAGCATGT | qRT-PCR |
| R | GTTGTGTGGCTCGGTACTGA | ||
| StERF53 | F | CAGACTGCGCATCATGCTTC | |
| R | TGTCCCAAGTTGGCTCTTCC | ||
| Ef1α | F | GATGGTCAGACCCGTGAACA | 内参基因 Reference gene |
| R | CCTTGGAGTACTTCGGGGTG | ||
| HYG | F | GCTTCTGCGGGCGATTTGTGT | 转基因植株鉴定 Transgenic plant identification |
| R | GGTCGCGGAGGCTATGGATGC | ||
表1 本研究中所用引物
Table 1 Primers used in this study
| 基因名称/ID Gene name/ID | 引物序列(5′-3′) Primer sequence | 用途 Application | |
|---|---|---|---|
| pCAMBIA1300‐3 5S‐StRGLG1 | F | AGAACACGGGGGACGAGCTCATGGGGAATCAAGAGTCTGC | 载体构建 Construction of vector |
| R | TGCTCACCATGTCGACCTAGCTATATAGTCTTATGCGAGTT | ||
| pEGFP-amiR-StRGLG1 | I miR-s | gaTATGGAATTTACAGTAGCCTAtctctcttttgtattcc | |
| II miR-a | gaTAGGCTACTGTAAATTCCATAtcaaagagaatcaatga | ||
| III miR*s | gaTAAGCTACTGTAATTTCCATTtcacaggtcgtgatatg | ||
| IV miR*a | gaAATGGAAATTACAGTAGCTTAtctacatatatattcct | ||
| A | CTGCAAGGCGATTAAGTTGGGTAAC | ||
| B | CTGTTTCCTGTGTGAAATTGTTATCCGC | ||
| pGBKT7‐StRGLG1 | F | AGGAGGACCTGCATATGATGGGGAATCAAGAGTCTGC | |
| R | GCCGCTGCAGGTCGACCTAGCTATATAGTCTTATGCGAGTT | ||
| pGADT7‐StERF53 | F | GGAGGCCAGTGAATTATGGCAGCTATGGATTTTTGGAA | |
| R | TTCATCTGCAGCTCGTTATAGGGAGGCCCAATCAATTTCA | ||
| pSPYNE-StRGLG1 | F | CACGGGGGACTCTAGATGGGGAATCAAGAGTCTGC | |
| R | TCCATCCCGGGAGCGGCTATATAGTCTTATGCGAGTTTT | ||
| pSPYCE-StERF53 | F | CACGGGGGACTCTAGATGGCAGCTATGGATTTTTGGAA | |
| R | TACATCCCGGGAGCGTAGGGAGGCCCAATCAATTTCATGA | ||
| StRGLG1 | F | ACCACACACGATCAGCATGT | qRT-PCR |
| R | GTTGTGTGGCTCGGTACTGA | ||
| StERF53 | F | CAGACTGCGCATCATGCTTC | |
| R | TGTCCCAAGTTGGCTCTTCC | ||
| Ef1α | F | GATGGTCAGACCCGTGAACA | 内参基因 Reference gene |
| R | CCTTGGAGTACTTCGGGGTG | ||
| HYG | F | GCTTCTGCGGGCGATTTGTGT | 转基因植株鉴定 Transgenic plant identification |
| R | GGTCGCGGAGGCTATGGATGC | ||

图1 StRGLG1在马铃薯不同组织中的相对表达水平(A)和干旱胁迫下StRGLG1基因的相对表达量(B) WS1:水分胁迫组1(75% ~ 85%);WS2:水分胁迫组2(55% ~ 65%);WS3:水分胁迫组3(35% ~ 45%);WS4:水分胁迫组4(15% ~ 25%)。不同小写字母表示差异显著(n= 3;P< 0.05),下同
Fig. 1 The relative expression level of StRGLG1 in different potato tissues(A)and the relative expression level of StRGLG1 gene under drought stress(B) WS1:Water stress group 1(75%-85%);WS2:Water stress group 2(55%-65%);WS3:Water stress group 3(35%-45%);WS4:Water stress group 4(15%-25%). Different lowercase letters indicated significant differences (n=3;P< 0.05). The same below

图2 转基因植物的获取与鉴定 A、B:愈伤组织;C、D:分化芽;E、F:转基因植株生根和筛选;G、H:转基因植株的PCR检测;I、J:StRGLG1在转基因植株和非转基因植株(NT)中的相对表达量。M:DL 2000分子标记;1:阳性对照质粒;2:非转基因植物的阴性对照;3 ~ 5:转基因株系。A、C、E、G、I:携带重组质粒pCAMBIA1300-35S-StRGLG1的植物转化过程;B、D、F、H、J:携带重组质粒pEGFP-amiR-StRGLG1的植物转化过程
Fig. 2 Acquisition and identification of transgenic plants A,B:Calli;C,D:Differentiated buds;E,F:Rooting and screening of transgenic plants;G,H:PCR detection of transgenic plants;I,J:Relative expression levels ofStRGLG1in transgenic plants and non-transgenic plants(NT). M:DL 2000 molecular marker;1:Positive control plasmid;2:Negative control of non-transgenic plants;3-5:Transgenic lines. A,C,E,G,I:Plant transformation process carrying recombinant plasmid pCAMBIA1300-35S-StRGLG1;B,D,F,H,J:Plant transformation process carrying recombinant plasmid pEGFP-amiR-StRGLG1
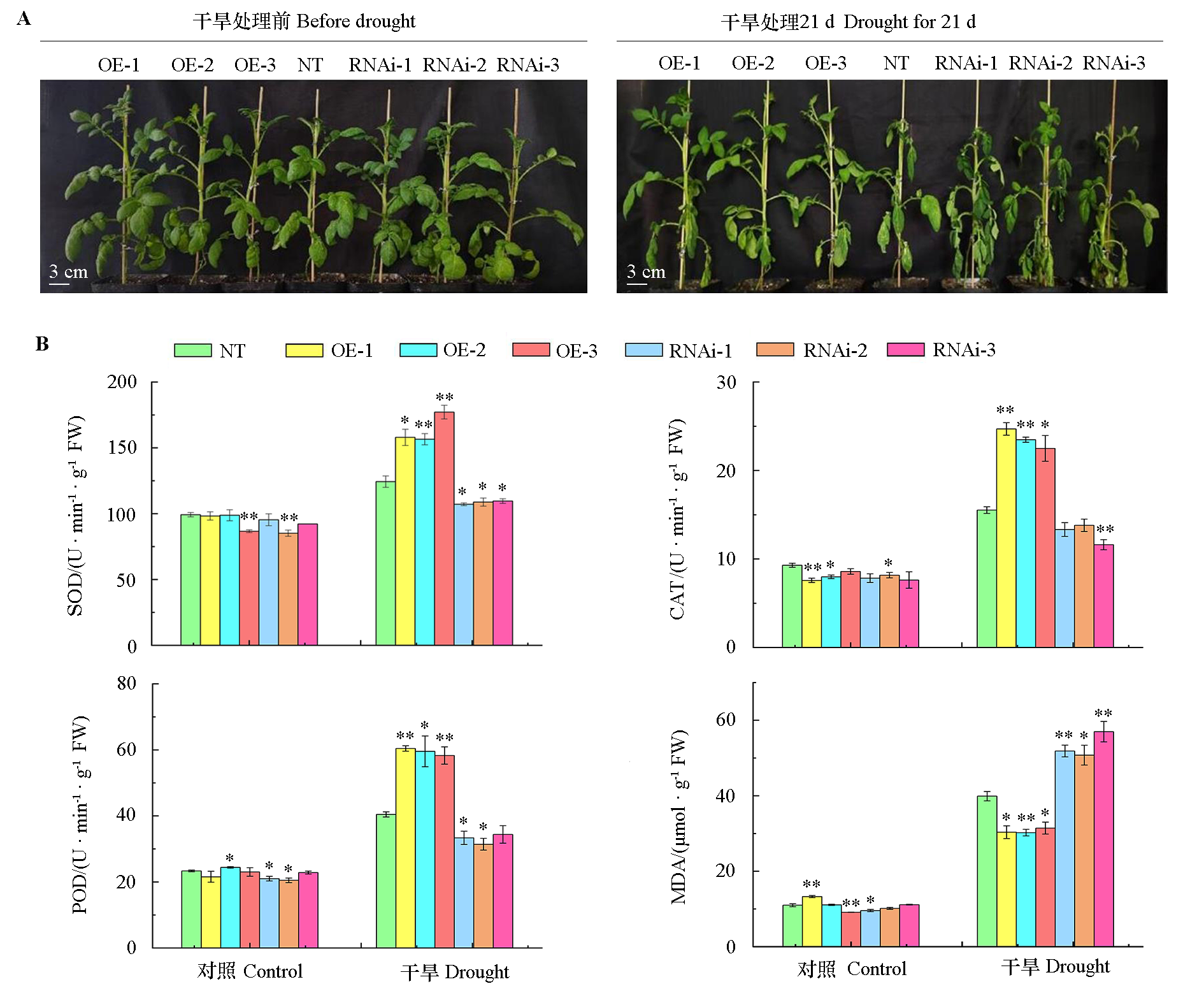
图3 转基因马铃薯在干旱胁迫21 d的表型(A)和生理生化指标的测定(B) *和**分别代表不同株系与非转基因植株之间的显著性差异水平和极显著性差异水平
Fig. 3 Phenotype(A)and determination of physiological and biochemical indexes(B)of transgenic potato at 21 days under drought stress * and ** respectively represent the significant difference levels and extremely significant difference levels between different strains and non-transgenic plants *P< 0.05;**P< 0.01,n= 3
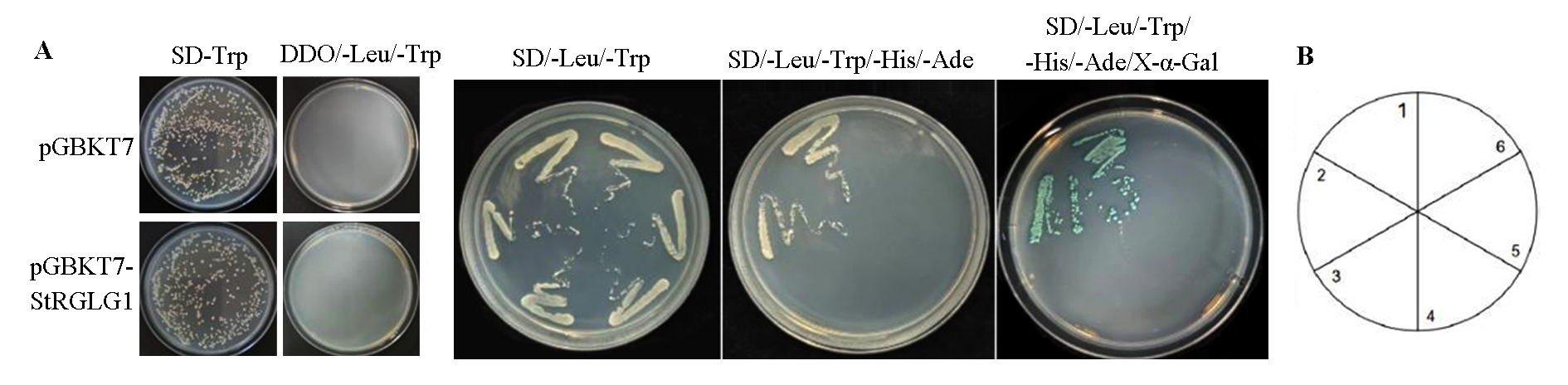
图4 诱饵载体pGBKT7-StRGLG1的毒性检测(A)和诱饵载体pGBKT7-StRGLG1的自激活检测(B) 1,2:阳性对照 pGADT7-RecT + pGBKT7-53;3,4:阴性对照 pGADT7-RecT + pGBKT7-Lam;5,6:试验组pGADT7 + pGBKT7-StRGLG1
Fig. 4 Toxicity detection of bait vector pGBKT7-StRGLG1(A)and self-activation detection of decoy vector pGBKT7-StRGLG1(B) 1,2:Positive control pGADT7-RecT + pGBKT7-53;3,4:Negative control pGADT7-RecT + pGBKT7-Lam;5,6:Experimental group pGADT7 + pGBKT7-StRGLG1

图5 酵母双杂交实验及BiFC验证 A:StRGLG1与StERF53的一对一验证;B:BiFC分析检测本氏烟草中StRGLG1与StERF53的互作
Fig. 5 Yeast two-hybrid experiment and BiFC verification A:StRGLG1 and StERF53 one-on-one validation;B:The interaction between StRGLG1 and StERF53 in tobacco was detected by BiFC analysis
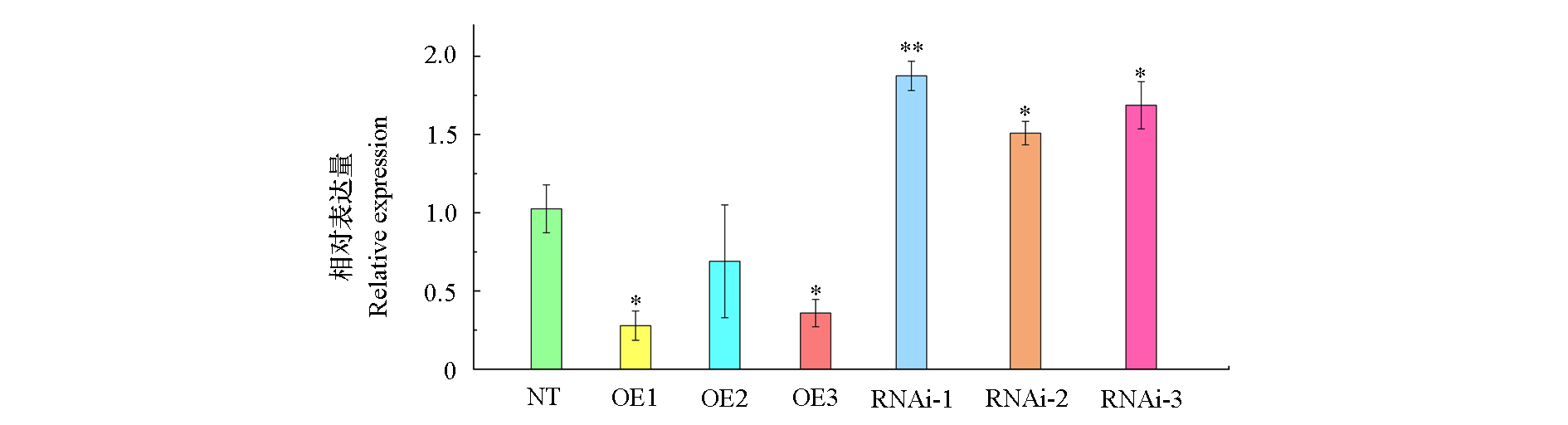
图6 qRT-PCR检测干旱胁迫下非转基因植株和转基因StRGLG1植株叶片中StERF53基因的相对表达量
Fig. 6 The relative expression of StERF53 gene in leaves of non-transgenic plants and transgenic StRGLG1 plants under drought stress was detected by qRT-PCR n= 3;*P< 0.05;**P< 0.01
| [1] |
|
| [2] |
doi: 10.1111/tpj.14274 |
| [3] |
|
| [4] |
|
| [5] |
|
|
杜琳颖. 2023. 小麦转录因子TaERF87与TaDi19-7的鉴定及其在非生物胁迫响应中的功能研究[博士论文]. 杨凌: 西北农林科技大学.
|
|
| [6] |
|
| [7] |
doi: 10.1104/pp.59.2.309 pmid: 16659839 |
| [8] |
|
| [9] |
doi: 10.1126/science.aaz7614 pmid: 32299946 |
| [10] |
|
| [11] |
|
| [12] |
doi: 10.1016/0003-9861(68)90654-1 pmid: 5655425 |
| [13] |
|
| [14] |
|
| [15] |
pmid: 17526739 |
| [16] |
|
| [17] |
|
| [18] |
|
|
罗雨. 2024. 马铃薯StMAPKK5正向调控干旱和盐胁迫的响应[硕士论文]. 兰州: 甘肃农业大学.
|
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
doi: 10.1038/s41477-019-0361-8 pmid: 30737511 |
| [26] |
|
| [27] |
doi: 10.1016/j.bbagrm.2011.08.004 pmid: 21867785 |
| [28] |
doi: 10.3109/07388551.2015.1134437 pmid: 26796880 |
| [29] |
|
| [30] |
|
| [31] |
doi: 10.1105/tpc.7.2.173 pmid: 7756828 |
| [32] |
|
| [33] |
|
| [34] |
doi: 10.3109/10409238.2011.620943 pmid: 21981143 |
| [35] |
|
| [36] |
doi: 10.1128/MCB.01094-09 pmid: 20194622 |
| [37] |
pmid: 15238540 |
| [38] |
|
|
司怀军, 谢从华, 柳俊. 2003. 农杆菌介导的马铃薯试管薯遗传转化体系的优化及反义classⅠpatatin基因的导入. 作物学报, 29(6):29801-29805.
|
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
doi: 10.1007/s11103-007-9237-9 pmid: 17874224 |
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
|
张宁, 司怀军, 王蒂. 2005. 拟南芥rd29A基因启动子克隆及其在马铃薯抗胁迫转基因中的应用. 作物学报, 31(2):159-164.
|
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [1] | 杨 利, 覃 亚, 边巴次仁, 珍 珍, 穷 吉, 白玛曲珍, 周 雅. 彩色马铃薯新品种‘喜格孜2号’[J]. 园艺学报, 2025, 52(S1): 145-146. |
| [2] | 窦雪婷, 朱熙, 张宁, 司怀军. 马铃薯低温胁迫相关基因StHY5的功能分析[J]. 园艺学报, 2025, 52(7): 1745-1757. |
| [3] | 宋倩娜, 宋陆帅, 段永红, 白小东, 冯瑞云. 马铃薯CRISPR/Cas9介导的毛状根高效基因编辑体系的建立[J]. 园艺学报, 2025, 52(7): 1758-1768. |
| [4] | 叶艳然, 刘建刚, 卞春松, 郭华春, 金黎平. 利用RGB影像量化分析不同氮素管理对马铃薯生长的影响[J]. 园艺学报, 2025, 52(7): 1870-1882. |
| [5] | 祝兴喆, 苏仙月, 苏旺, 张红林, 潘哲超, 刘涛, 徐笑宇. 两个马铃薯品种冬、春种植模式下叶片糖苷生物碱合成代谢差异分析[J]. 园艺学报, 2025, 52(7): 1883-1900. |
| [6] | 李姿燕, 陈炜曦, 李子涵, 黎茵, 梁峰铭, 曾祥利, 荐红举, 吕典秋. 基于RNA-Seq筛选调控马铃薯熟性的候选基因[J]. 园艺学报, 2025, 52(6): 1505-1518. |
| [7] | 萧志浩, 郑涵锴, 张曼楠, 唐怀千, 王嘉颖, 张余洋, 张俊红, 叶志彪, 叶杰. 非生物胁迫下钾对番茄苗期生长发育的影响[J]. 园艺学报, 2025, 52(6): 1599-1618. |
| [8] | 林茜, 邓振鹏, 阳新月, 周克友, 易小平, 王季春. 减施化肥配施有机肥对马铃薯产量及养分利用的影响[J]. 园艺学报, 2025, 52(4): 1007-1019. |
| [9] | 周进华, 白磊, 张锐, 郭华春. 秸秆覆盖降温栽培对马铃薯生长的影响[J]. 园艺学报, 2025, 52(2): 453-466. |
| [10] | 黄勋, 刘霞, 邓琳梅, 王兴国, 徐亚锦, 杨艳丽. 马铃薯疮痂病生防菌1X1Y的鉴定及其生防促生特性研究[J]. 园艺学报, 2025, 52(1): 229-246. |
| [11] | 仲阳, 秦亚芝, 罗帅, 荆玉玲, 王万兴, 李广存, 胡新喜, 秦玉芝, 程旭, 熊兴耀. 泥炭和蘑菇渣改土对马铃薯根源微生物组及产量的影响[J]. 园艺学报, 2024, 51(9): 2143-2154. |
| [12] | 武祥琪, 孙鹂, 俞浙萍, 俞沁佩, 梁森苗, 郑锡良, 戚行江, 张淑文. 杨梅MrSPL4在响应干旱和低温胁迫中的作用研究[J]. 园艺学报, 2024, 51(5): 927-938. |
| [13] | 范国权, 喻江, 高艳玲, 李庆全, 张抒, 于镇华. 马铃薯种薯催芽、切块和包衣对其立枯丝核菌病的影响[J]. 园艺学报, 2024, 51(5): 1151-1161. |
| [14] | 强然, 张岱, 杨喆, 陈明玥, 赵景, 朱杰华. 解淀粉芽胞杆菌L19对马铃薯枯萎病菌的抑制及植株的促生作用[J]. 园艺学报, 2024, 51(4): 875-892. |
| [15] | 刘晋红, 王峥, 于昊, 辛依睿, 亓果宁, 柳参奎, 任慧敏. 毛竹SLAC家族基因鉴定及PheSLAC1功能分析[J]. 园艺学报, 2024, 51(3): 545-559. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||
版权所有 © 2012 《园艺学报》编辑部 京ICP备10030308号-2 国际联网备案号 11010802023439
编辑部地址: 北京市海淀区中关村南大街12号中国农业科学院蔬菜花卉研究所 邮编: 100081
电话: 010-82109523 E-Mail: yuanyixuebao@126.com
技术支持:北京玛格泰克科技发展有限公司