
园艺学报 ›› 2025, Vol. 52 ›› Issue (2): 309-321.doi: 10.16420/j.issn.0513-353x.2023-0903
收稿日期:2024-09-21
修回日期:2024-12-26
出版日期:2025-02-25
发布日期:2025-02-23
通讯作者:
基金资助:
WEN Zhengyang, SUN Jingbo, ZHANG Mengxia, ZHANG Feng, DONG Chunjuan*( )
)
Received:2024-09-21
Revised:2024-12-26
Published:2025-02-25
Online:2025-02-23
摘要:
利用生物信息方法从黄瓜(Cucumis sativus L.)基因组中克隆到7个铜胺氧化酶(copper amine oxidase,CuAO)基因,其编码蛋白的氨基酸长度在652 ~ 710 aa之间,等电点介于5.41 ~ 8.31之间,系统进化树分析将其分为3个亚族。采用CuAO底物腐胺处理后,黄瓜下胚轴不定根数量增加,而CuAO特异抑制剂氨基胍处理后,不定根数量显著减少;将CuAO的催化产物H2O2与氨基胍复配处理可有效消除氨基胍的抑制效应。qRT-PCR分析发现CsCuAOβ和CsCuAOζ在不定根形成的早期(24 h)高表达,CsCuAOγ1在不定根形成的后期(72 ~ 120 h)高表达;进一步分析不同植物生长调节剂和H2O2信号对CsCuAOβ、CsCuAOζ和CsCuAOγ1的表达调控,发现生长素(IAA)抑制CsCuAOβ和CsCuAOζ的表达,而乙烯合成前体氨基环丙烷羧酸(ACC)促进二者的表达,IAA和ACC对CsCuAOγ1的表达无显著影响,H2O2对三者的表达均有不同程度的诱导作用。将CsCuAOβ、CsCuAOζ、CsCuAOγ1在黄瓜子叶中瞬时表达,发现3个基因均可使子叶中CuAO活性升高,H2O2积累量增加,CsCuAOβ过量表达可促进子叶柄部位不定根形成,而CsCuAOγ1和CsCuAOζ过量表达对不定根形成无显著影响。试验结果表明,黄瓜CsCuAOβ响应乙烯信号,通过产生H2O2信号促进黄瓜不定根形成。
温正阳, 孙靖博, 张梦夏, 张锋, 董春娟. 黄瓜CsCuAO家族基因鉴定及其在不定根形成中的作用研究[J]. 园艺学报, 2025, 52(2): 309-321.
WEN Zhengyang, SUN Jingbo, ZHANG Mengxia, ZHANG Feng, DONG Chunjuan. Identification of CsCuAO Gene Family in Cucumber and Their Regulatory Roles in Adventitious Root Formation[J]. Acta Horticulturae Sinica, 2025, 52(2): 309-321.
| 用途Use | 基因Gene | 引物序列(5′-3′) Primer sequence |
|---|---|---|
| 基因克隆 | CsCuAOα1 | F:CATTTGTTTTCAATATATGATTAATGTG;R:ACAAACTCTCAAATCAAATGACCG |
| Gene cloning | CsCuAOα2 | F:TTCTCTTCTCCCTCTCACTCCT;R:GACACAACTCATTTAGCTTGTTATTC |
| CsCuAOα3 | F:GCCACACCCCTAACATATACATC;R:CGCAAGAGTTGTGGATGAATATC | |
| CsCuAOβ | F:ATGAATCCTCTTCTGTTTCTTCTTG;R:TCATTTAAGTAAAGGGTTTCTATCAAAG | |
| CsCuAOγ1 | F:CTTACCTCGTCCTTCACTACC;R:TTGTCAATCAAGCCGAGGC | |
| CsCuAOγ2 | F:CCACCCAATAAGACAAAGAAAGC;R:CGAGCATTACACACAGGCA | |
| CsCuAOζ | F:CGGAGGATAAGAGGAGAAGTGTG;R:GAGCAGTGATGAAGAAGAGAGAGT | |
| qRT-PCR | CsCuAOα1 | F:GCGGGTGGAACTGAGTACAG;R:TTTGCCCAACTAACGGAGTGA |
| CsCuAOα2 | F:TGGACTCTCAGGAACAGGAAGA;R:GGTCTAAGCTCAAAGCCACG | |
| CsCuAOα3 | F:GACACACTGTCAGTTGGGCA;R:CCGAGATTTGGCCTCGGTAT | |
| CsCuAOβ | F:TGATTAGACGTGGGGAAGCAG;R:CCCGTTAAAGCAACCCCAAC | |
| CsCuAOγ1 | F:ATGGAAAGCCGTATGTGCGA;R:CTCAGTGATATCCATGCCGGT | |
| CsCuAOγ2 | F:ACACTTGTAGCTCGCATGGT;R:ATAGCCCAACCTCAACACGA | |
| CsCuAOζ | F:TCCAAAGGTGTTGTTCCTCCAA;R:TATCTCTGACCTCTGGCGTG | |
| CsActin-7 | F:CCCATCTATGAGGGTTACGCC;R:TGAGAGCATCAGTAAGGTCACGA | |
| 瞬时表达载体构建 Construction of transient expression vector | CsCuAOβ | F:GGACAGGGTACCCGGGGATCCATGAATCCTCTTCTGTTTCTTCTTGTAC; R:AGTGTCGACTCAGAGGATCCTCATTTAAGTAAAGGGTTTCTATCAAAGT |
| CsCuAOγ1 | F:GGACAGGGTACCCGGGGATCCATGGCTGCCAGAAAATATCTCCTC; R:AGTGTCGACTCAGAGGATCCTCAAGCCGAGGCAGCAGGCTTGC | |
| CsCuAOζ | F:GGACAGGGTACCCGGGGATCCATGGCCCCAGCTTCGAAA; R:AGTGTCGACTCAGAGGATCCTTAGAGCTTAGCGATGATGGGAG |
表1 本研究中所用的引物
Table 1 Primers used in this study
| 用途Use | 基因Gene | 引物序列(5′-3′) Primer sequence |
|---|---|---|
| 基因克隆 | CsCuAOα1 | F:CATTTGTTTTCAATATATGATTAATGTG;R:ACAAACTCTCAAATCAAATGACCG |
| Gene cloning | CsCuAOα2 | F:TTCTCTTCTCCCTCTCACTCCT;R:GACACAACTCATTTAGCTTGTTATTC |
| CsCuAOα3 | F:GCCACACCCCTAACATATACATC;R:CGCAAGAGTTGTGGATGAATATC | |
| CsCuAOβ | F:ATGAATCCTCTTCTGTTTCTTCTTG;R:TCATTTAAGTAAAGGGTTTCTATCAAAG | |
| CsCuAOγ1 | F:CTTACCTCGTCCTTCACTACC;R:TTGTCAATCAAGCCGAGGC | |
| CsCuAOγ2 | F:CCACCCAATAAGACAAAGAAAGC;R:CGAGCATTACACACAGGCA | |
| CsCuAOζ | F:CGGAGGATAAGAGGAGAAGTGTG;R:GAGCAGTGATGAAGAAGAGAGAGT | |
| qRT-PCR | CsCuAOα1 | F:GCGGGTGGAACTGAGTACAG;R:TTTGCCCAACTAACGGAGTGA |
| CsCuAOα2 | F:TGGACTCTCAGGAACAGGAAGA;R:GGTCTAAGCTCAAAGCCACG | |
| CsCuAOα3 | F:GACACACTGTCAGTTGGGCA;R:CCGAGATTTGGCCTCGGTAT | |
| CsCuAOβ | F:TGATTAGACGTGGGGAAGCAG;R:CCCGTTAAAGCAACCCCAAC | |
| CsCuAOγ1 | F:ATGGAAAGCCGTATGTGCGA;R:CTCAGTGATATCCATGCCGGT | |
| CsCuAOγ2 | F:ACACTTGTAGCTCGCATGGT;R:ATAGCCCAACCTCAACACGA | |
| CsCuAOζ | F:TCCAAAGGTGTTGTTCCTCCAA;R:TATCTCTGACCTCTGGCGTG | |
| CsActin-7 | F:CCCATCTATGAGGGTTACGCC;R:TGAGAGCATCAGTAAGGTCACGA | |
| 瞬时表达载体构建 Construction of transient expression vector | CsCuAOβ | F:GGACAGGGTACCCGGGGATCCATGAATCCTCTTCTGTTTCTTCTTGTAC; R:AGTGTCGACTCAGAGGATCCTCATTTAAGTAAAGGGTTTCTATCAAAGT |
| CsCuAOγ1 | F:GGACAGGGTACCCGGGGATCCATGGCTGCCAGAAAATATCTCCTC; R:AGTGTCGACTCAGAGGATCCTCAAGCCGAGGCAGCAGGCTTGC | |
| CsCuAOζ | F:GGACAGGGTACCCGGGGATCCATGGCCCCAGCTTCGAAA; R:AGTGTCGACTCAGAGGATCCTTAGAGCTTAGCGATGATGGGAG |
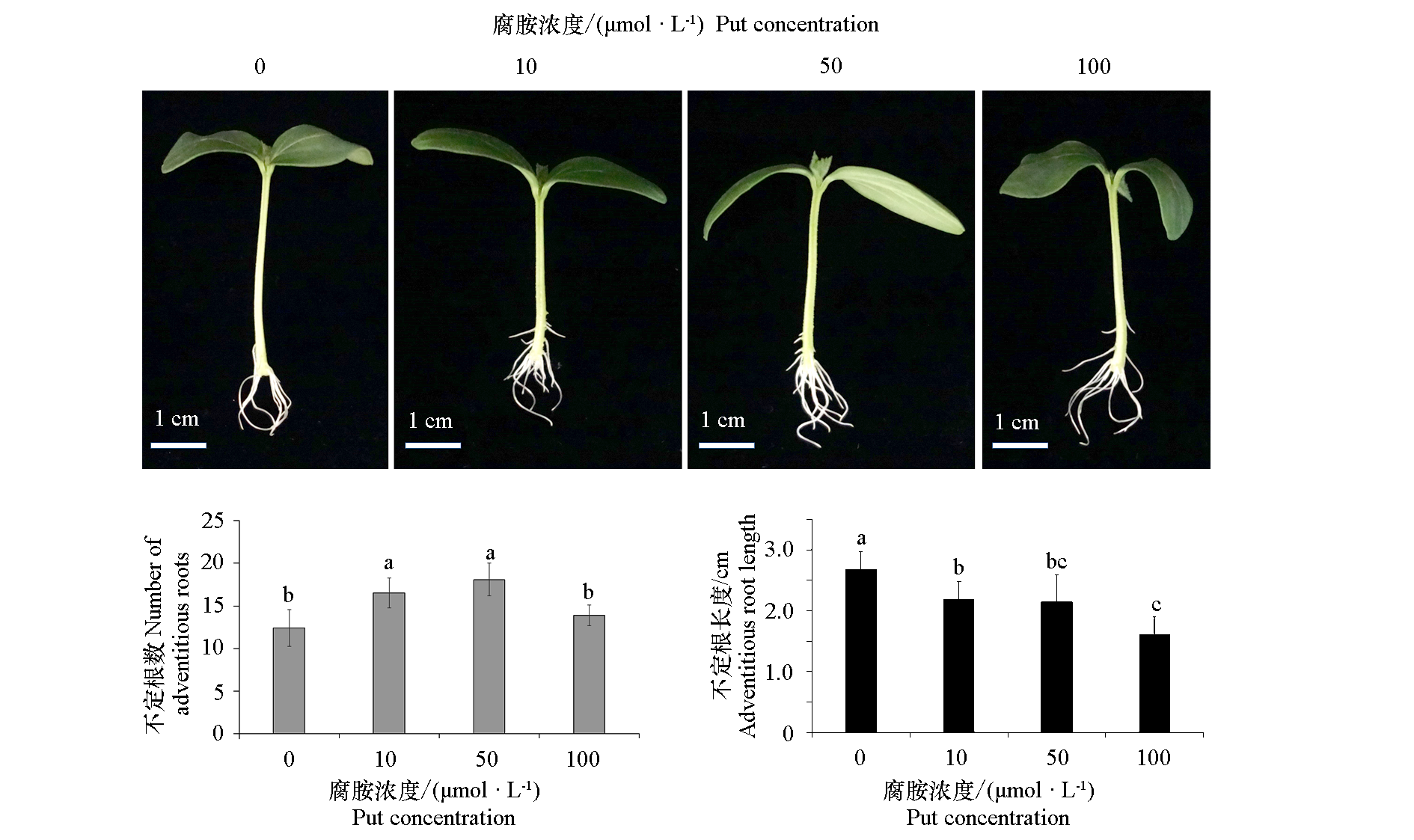
图1 腐胺(Put)处理对黄瓜不定根形成的影响 采用SPSS 26.0软件进行one-way ANOVA分析,不同小写字母表示不同处理间差异显著(P < 0.05)
Fig. 1 Effect of putrescine(Put)application on adventitious root formation of cucumber seedlings Statistical analysis was carried out with SPSS 26.0 software,using one-way ANOVA analysis. Different lowercases indicate significant differences among different treatments(P < 0.05)

图2 CuAO抑制剂氨基胍(AG)对黄瓜不定根形成的影响 采用SPSS 26.0软件进行one-way ANOVA分析,不同小写字母表示处理间差异显著(P < 0.05)
Fig. 2 Effect of aminoguanidine(AG)application on adventitious root formation of cucumber seedlings Statistical analysis was carried out with SPSS 26.0 software,using one-way ANOVA analysis. Different lowercases indicate significant differences among different treatments(P < 0.05)
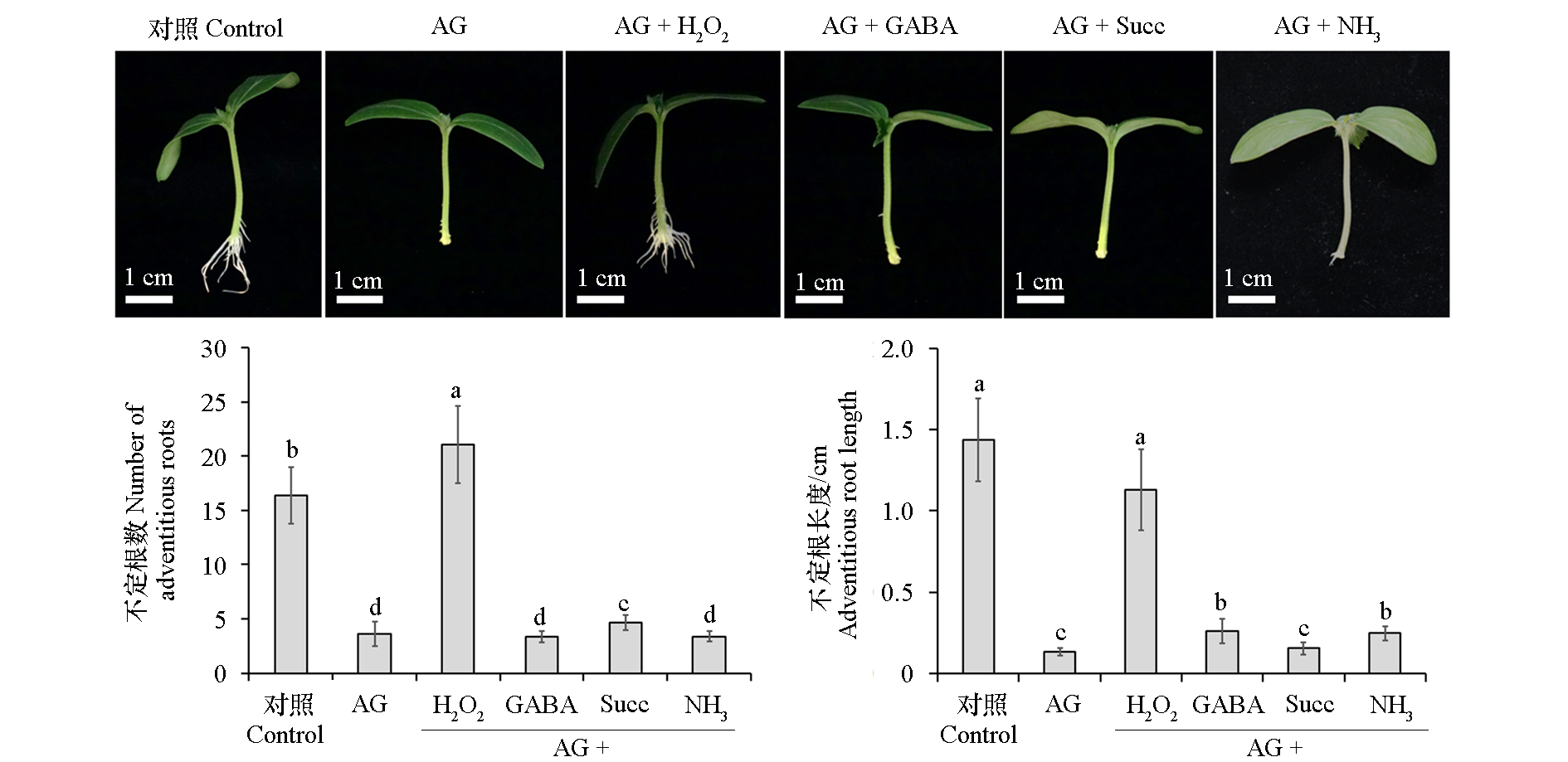
图3 氨基胍(AG)与H2O2、γ-氨基丁酸(GABA)、琥珀酸(Succ)和NH3复配处理对黄瓜不定根形成的影响 采用SPSS 26.0软件进行one-way ANOVA分析,不同小写字母表示处理间差异显著(P < 0.05)
Fig. 3 Effect of co-application of aminoguanidine(AG)with H2O2,γ-aminobutyric acid(GABA),succinic acid(Succ) and NH3 on adventitious root formation of cucumber seedlings Statistical analysis was carried out with SPSS 26.0 software,using one-way ANOVA analysis. Different lowercases indicate significant differences among different treatments(P < 0.05)
| 基因名称 Gene name | 序列号 Accession No. | 基因位置 Gene locus | 基因长/bp Gene length | 外显子数 Exon number | 内含子数 Intron number | ORF/bp | 蛋白长/aa Protein length | 分子量/kD MW | 等电点 pI |
|---|---|---|---|---|---|---|---|---|---|
| CsCuAOα1 | CsaV3_7G022600 | Chr7:11469830 ~ 11476230 | 6 401 | 5 | 4 | 2 037 | 678 | 77.27 | 6.49 |
| CsCuAOα2 | CsaV3_6G038130 | Chr6:21656887 ~ 21661068 | 4 182 | 5 | 4 | 2 007 | 668 | 75.33 | 6.51 |
| CsCuAOα3 | CsaV3_6G038150 | Chr6: 21670803 ~ 21666955 | 3 849 | 6 | 5 | 1 983 | 660 | 75.01 | 5.88 |
| CsCuAOβ | CsaV3_6G038140 | Chr6:21661851 ~ 21664612 | 2 762 | 4 | 3 | 1 959 | 652 | 74.23 | 8.73 |
| CsCuAOγ1 | CsaV3_5G003800 | Chr5:2454206 ~ 2458762 | 4 557 | 4 | 3 | 2 178 | 725 | 81.37 | 5.79 |
| CsCuAOγ2 | CsaV3_5G003790 | Chr5:2448731 ~ 2453203 | 4 473 | 6 | 5 | 2 133 | 710 | 80.45 | 5.41 |
| CsCuAOζ | CsaV3_1G001170 | Chr1:659948 ~ 667885 | 7 938 | 12 | 11 | 2 115 | 704 | 79.27 | 6.29 |
表2 黄瓜CsCuAO基因家族成员的序列特征
Table 2 Sequence characteristics of CsCuAO gene family members
| 基因名称 Gene name | 序列号 Accession No. | 基因位置 Gene locus | 基因长/bp Gene length | 外显子数 Exon number | 内含子数 Intron number | ORF/bp | 蛋白长/aa Protein length | 分子量/kD MW | 等电点 pI |
|---|---|---|---|---|---|---|---|---|---|
| CsCuAOα1 | CsaV3_7G022600 | Chr7:11469830 ~ 11476230 | 6 401 | 5 | 4 | 2 037 | 678 | 77.27 | 6.49 |
| CsCuAOα2 | CsaV3_6G038130 | Chr6:21656887 ~ 21661068 | 4 182 | 5 | 4 | 2 007 | 668 | 75.33 | 6.51 |
| CsCuAOα3 | CsaV3_6G038150 | Chr6: 21670803 ~ 21666955 | 3 849 | 6 | 5 | 1 983 | 660 | 75.01 | 5.88 |
| CsCuAOβ | CsaV3_6G038140 | Chr6:21661851 ~ 21664612 | 2 762 | 4 | 3 | 1 959 | 652 | 74.23 | 8.73 |
| CsCuAOγ1 | CsaV3_5G003800 | Chr5:2454206 ~ 2458762 | 4 557 | 4 | 3 | 2 178 | 725 | 81.37 | 5.79 |
| CsCuAOγ2 | CsaV3_5G003790 | Chr5:2448731 ~ 2453203 | 4 473 | 6 | 5 | 2 133 | 710 | 80.45 | 5.41 |
| CsCuAOζ | CsaV3_1G001170 | Chr1:659948 ~ 667885 | 7 938 | 12 | 11 | 2 115 | 704 | 79.27 | 6.29 |
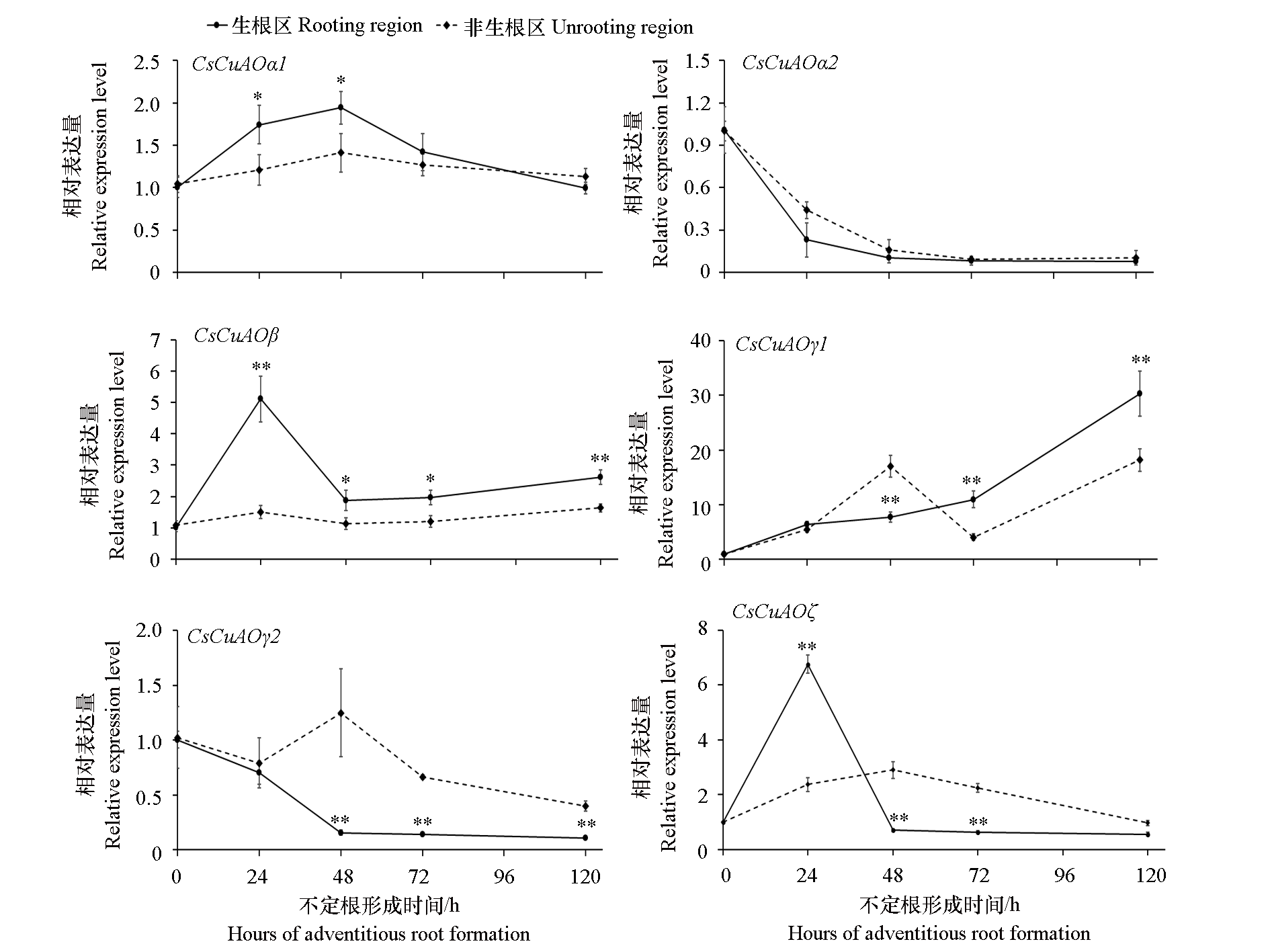
图5 黄瓜不定根形成过程中CsCuAO的表达量变化 采用SPSS 26.0软件采用t检验进行统计学分析,* P < 0.05,** P < 0.01
Fig. 5 Expression patterns of CsCuAO genes during adventitious root formation of cucumber Statistical analysis was carried out using SPSS 26.0 software by t-test. * P < 0.05,** P < 0.01
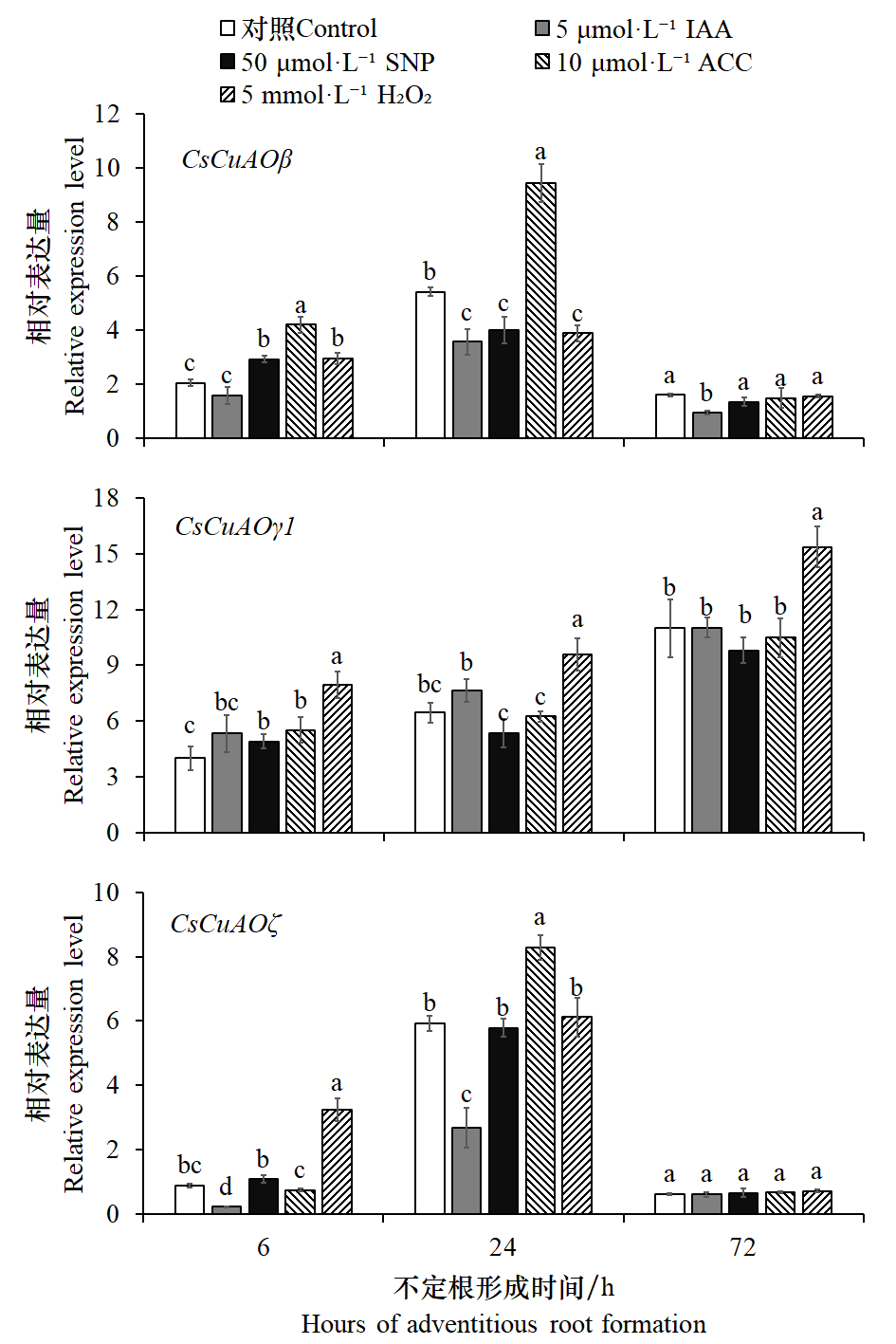
图6 黄瓜不定根形成过程中CsCuAOβ、CsCuAOγ1和CsCuAOζ对激素和H2O2信号的表达响应 采用SPSS 26.0软件进行one-way ANOVA分析,不同小写字母表示处理间差异显著(P < 0.05)
Fig. 6 Expression levels of CsCuAOβ, CsCuAOγ1 and CsCuAOζ during adventitious root formation in response to plant hormones and H2O2 Statistical analysis was carried out with SPSS 26.0 software,using one-way ANOVA analysis. Different lowercases indicate significant differences among different treatments(P < 0.05)
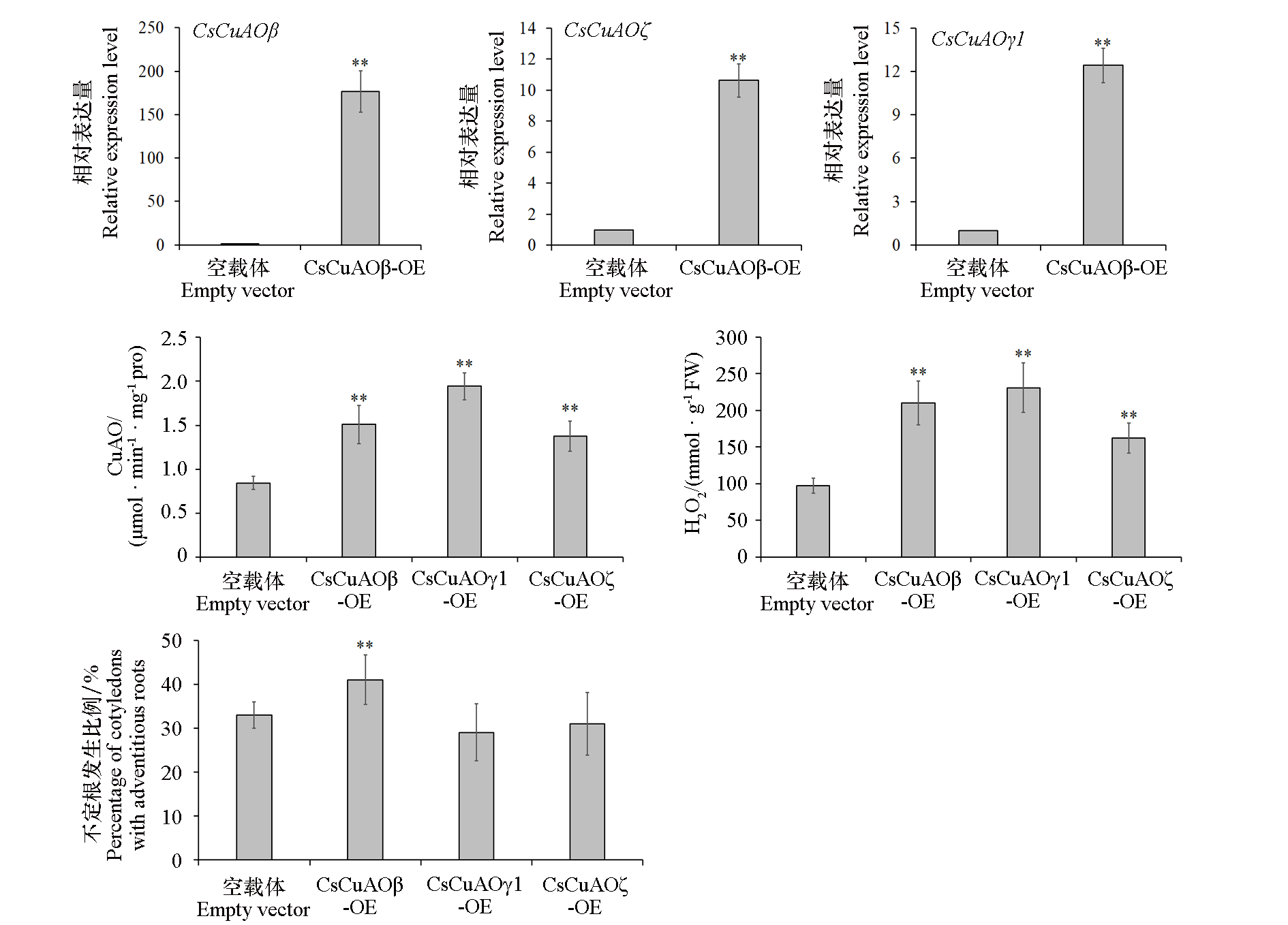
图7 CsCuAOβ、CsCuAOγ1和CsCuAOζ在黄瓜子叶中瞬时表达量及其对CuAO活性、H2O2含量和不定根形成的影响 采用SPSS 26.0软件采用t检验进行统计学分析,* P < 0.05,** P < 0.01
Fig. 7 Effects of transient expression of CsCuAOβ,CsCuAOγ1 and CsCuAOζ on adventitious root formation in cucumber cotyledon Statistical analysis was carried out using SPSS 26.0 software by t-test. * P < 0.05,** P < 0.01
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
doi: 10.1038/s41477-021-00887-0 pmid: 33846592 |
| [6] |
|
| [7] |
|
| [8] |
doi: 10.16420/j.issn.0513-353x.2016-0184 URL |
|
董春娟, 曹宁, 王玲玲, 张焕欣, 王红飞, 台连丽, 尚庆茂. 2016. 黄瓜子叶源生长素对下胚轴不定根发生的调控作用. 园艺学报, 43 (10):1929-1940.
doi: 10.16420/j.issn.0513-353x.2016-0184 URL |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
|
马永硕. 2017. 黄瓜中苦味素的生物合成、调控及转运机制[博士论文]. 北京: 中国农业科学院.
|
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
|
徐港明. 2016. 大豆下胚轴诱导不定根再生过程中二胺氧化酶基因表达及酶活性变化[硕士论文]. 苏州: 苏州大学.
|
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
doi: 10.16420/j.issn.0513-353x.2017-0156 URL |
|
张焕欣, 董春娟, 尚庆茂. 2017. 外源IBA对辣椒下胚轴不定根发生的调控作用. 园艺学报, 44 (10):1937-1948.
doi: 10.16420/j.issn.0513-353x.2017-0156 URL |
|
| [38] |
doi: 10.16420/j.issn.0513-353x.2020-1063 |
|
张静亚, 雷蕾, 尚庆茂, 谢露露, 董春娟. 2021. 番茄IAA甲基转移酶基因SlIAMT1和SlIAMT2的表达分析及其对下胚轴和根系发育的调控. 园艺学报, 48 (12):2385-2402.
doi: 10.16420/j.issn.0513-353x.2020-1063 |
|
| [39] |
|
| [40] |
|
| [41] |
doi: 10.1186/s12870-019-1700-7 pmid: 30866829 |
| [42] |
|
| [43] |
doi: 10.16420/j.issn.0513-353x.2021-1226 URL |
|
郑清波, 鲍泽洋, 蓝青青, 周钰雯, 周雨菲, 郑彩霞, 李旭. 2023. 童性与生长素对不定根发生的影响研究进展. 园艺学报, 50 (2):441-450.
doi: 10.16420/j.issn.0513-353x.2021-1226 URL |
| [1] | 毛欣, 元文飞, 郭雨润, 徐欣欣, 李艺, 张毅, 苗妍秀, 白龙强, 李衍素. 日光温室黄瓜有机物料种植板栽培中有机物料腐解及根区和叶片养分含量的变化[J]. 园艺学报, 2025, 52(2): 439-452. |
| [2] | 袁泉, 卢威, 王君, 陈茹, 李衍素, 于贤昌, 贺超兴, 孙敏涛, 闫妍. 日光温室不同土质灌水下限对早春黄瓜生长、产量和品质的影响[J]. 园艺学报, 2024, 51(6): 1377-1385. |
| [3] | 王文娇, 邢军杰, 申成丞, 李斌. 黄瓜蜡质基因CsCER1调控因子CsCOL5的筛选及其功能分析[J]. 园艺学报, 2024, 51(5): 1005-1016. |
| [4] | 张丛莹, 顾兴芳, 苗晗, 董邵云, 刘小萍, 官健涛, 张圣平. 黄瓜新品种‘中农脆玉1号’[J]. 园艺学报, 2024, 51(5): 1173-1174. |
| [5] | 于静, 冯向君, 金英学, 丁国华. 焦脱镁叶绿酸a对黄瓜枯萎病菌的抑制作用[J]. 园艺学报, 2024, 51(4): 859-874. |
| [6] | 张丛莹, 顾兴芳, 苗晗, 董邵云, 刘小萍, 官健涛, 张圣平. 黄瓜新品种‘中农脆绿2号’[J]. 园艺学报, 2024, 51(4): 919-920. |
| [7] | 刘艳艳, 丁颖, 刘兴华, 郑佳秋, 刘志钦. 辣椒CaSYT1的鉴定及其在疫霉侵染过程中的功能初探[J]. 园艺学报, 2024, 51(3): 533-544. |
| [8] | 刘梦, 贾惠婷, 周新刚. 黄瓜枯萎病菌共生细菌的分离鉴定及功能分析[J]. 园艺学报, 2024, 51(3): 643-655. |
| [9] | 冯一清, 仇胜囡, 吴月, 解阳, 张晓伟, 毕焕改, 艾希珍. 褪黑素对日光温室黄瓜耐冷性的影响[J]. 园艺学报, 2024, 51(11): 2633-2644. |
| [10] | 韩世文, 刘涛, 王丽萍, 李楠洋, 王素娜, 王星. 黄瓜SRS基因家族鉴定及胁迫响应表达分析[J]. 园艺学报, 2024, 51(10): 2281-2296. |
| [11] | 吴琼, 张甜甜, 李茂营, 吴慧玲, 郭绍贵, 张洁, 任毅, 张海英, 宫国义. 解淀粉芽孢杆菌5号防控西瓜CGMMV机制初探[J]. 园艺学报, 2024, 51(10): 2427-2438. |
| [12] | 蒋素华, 王林青, 吴景亮, 牛苏燕, 刘军, 崔波. 黄瓜新品种‘优NT603’[J]. 园艺学报, 2023, 50(8): 1807-1808. |
| [13] | 侯潞丹, 颜克兴, 董帅, 刘星雨, 常明昌, 孟俊龙. 信号分子H2O2调控糙皮侧耳菌盖颜色形成的机制初探[J]. 园艺学报, 2023, 50(6): 1243-1254. |
| [14] | 王泉城, 武军, 李磊, 石延霞, 谢学文, 李宝聚, 柴阿丽. 多主棒孢菌CcTLS1对黄瓜的致病机理分析[J]. 园艺学报, 2023, 50(3): 569-582. |
| [15] | 郑清波, 鲍泽洋, 蓝青青, 周钰雯, 周雨菲, 郑彩霞, 李旭. 童性与生长素对不定根发生的影响研究进展[J]. 园艺学报, 2023, 50(2): 441-450. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||
版权所有 © 2012 《园艺学报》编辑部 京ICP备10030308号-2 国际联网备案号 11010802023439
编辑部地址: 北京市海淀区中关村南大街12号中国农业科学院蔬菜花卉研究所 邮编: 100081
电话: 010-82109523 E-Mail: yuanyixuebao@126.com
技术支持:北京玛格泰克科技发展有限公司