
园艺学报 ›› 2024, Vol. 51 ›› Issue (3): 495-508.doi: 10.16420/j.issn.0513-353x.2023-0089
罗健东1, 邱梦青1, 周慧敏1, 解为玮1, 黄海鑫1, 刘洁琪1, 张梓敏1, 徐健2, 陈程杰1, 何业华1, 刘朝阳1,*( )
)
收稿日期:2023-04-24
修回日期:2023-11-30
出版日期:2024-03-25
发布日期:2024-03-22
通讯作者:
基金资助:
LUO Jiandong1, QIU Mengqing1, ZHOU Huimin1, XIE Weiwei1, Huang Haixin1, LIU Jieqi1, ZHANG Zimin1, XU Jian2, CHEN Chengjie1, HE Yehua1, LIU Chaoyang1,*( )
)
Received:2023-04-24
Revised:2023-11-30
Published:2024-03-25
Online:2024-03-22
摘要:
以‘神湾’菠萝为材料,克隆了1个C2H2型锌指蛋白基因,命名为AcZFP1,其开放阅读框为816 bp,编码271个氨基酸,含有2个典型的锌指蛋白结构域。进化树分析表明AcZFP1与水稻OsZFP252和OsMSR15的亲缘关系最近。基因表达分析发现,AcZFP1受低温、NaCl和聚乙二醇(PEG)干旱等多种逆境胁迫及外源ABA、SA和MeJA的诱导。试验表明,AcZFP1蛋白定位于细胞核中。AcZFP1过表达的拟南芥株系在低温处理后相比野生型对照有更高的成活率和Fv/Fm值,可溶性蛋白含量增加,SOD、POD酶活增强,MDA含量降低,植株的耐寒性显著增强。进一步的qRT-PCR分析显示,AcZFP1可以促进AtRD29A、AtCOR47等4个典型的拟南芥内源冷应答基因的表达,在低温胁迫中发挥正调控作用。
罗健东, 邱梦青, 周慧敏, 解为玮, 黄海鑫, 刘洁琪, 张梓敏, 徐健, 陈程杰, 何业华, 刘朝阳. 菠萝AcZFP1的克隆及其在低温胁迫下的功能分析[J]. 园艺学报, 2024, 51(3): 495-508.
LUO Jiandong, QIU Mengqing, ZHOU Huimin, XIE Weiwei, Huang Haixin, LIU Jieqi, ZHANG Zimin, XU Jian, CHEN Chengjie, HE Yehua, LIU Chaoyang. Cloning and Functional Analysis of Pineapple AcZFP1 Gene Under Low Temperature Stress[J]. Acta Horticulturae Sinica, 2024, 51(3): 495-508.
| 用途 Usage | 引物名称 Primer name | 引物序列(5′-3′) Sequence | ||
|---|---|---|---|---|
| 基因克隆 Gene cloning | AcZFP1-F AcZFP1-R | ATGGCAATTGATGCTTTAGA TCAAGCCGGGATTAGGAGCC | ||
| 亚细胞定位 Subcellular localization | C18-AcZFP1-F C18-AcZFP1-R | cggtatcgataagcttATGGCAATTGATGCTTTAGA cgggctgcaggaattcAGCCGGGATTAGGAGCCGG | ||
| 转化植株PCR验证 PCR assay of the transgenic plants | Det-AcZFP1-F Det-AcZFP1-R | CGCAGTACAAGTGCTCCGTA CGGGGCTTCTTGAAAGGGT | ||
| 实时荧光定量PCR Fluorescent quantitative real-time PCR(qRT-PCR) | qAcZFP1-F qAcZFP1-R qAcActin-F qAcActin-R qAtActin-F qAtActin-R qAtKIN1-F qAtKIN1-R qAtKIN2-F qAtKIN2-R qAtCOR47-F qAtCOR47-R qAtRD29A-F qAtRD29A-R | GTGCCACTACGAAGGAACGA GTTTTGCACCCTCAAACCCT CTGGCCTACGTGGCACTTGACTT CACTTCTGGGCAGCGGAACCTTT CCTTCGTCTTGATCTTGCGG AGCGATGGCTGGAACAGAAC ACCAACAAGAATGCCTTCCA CCGCATCCGATACACTCTTT GTCAGAGACCAACAAGAATGCC TGACTCGGATCGCTACTTGTTC CAGTGTCGGAGAGTGTGGTG ACAGCTGGTGAATCCTCTGC GCCGAGAAACTTCAGATTGG CCATTCCTCCTCCTCCTTTC | ||
表1 本研究中所用引物及序列
Table 1 Primers and sequences used in this study
| 用途 Usage | 引物名称 Primer name | 引物序列(5′-3′) Sequence | ||
|---|---|---|---|---|
| 基因克隆 Gene cloning | AcZFP1-F AcZFP1-R | ATGGCAATTGATGCTTTAGA TCAAGCCGGGATTAGGAGCC | ||
| 亚细胞定位 Subcellular localization | C18-AcZFP1-F C18-AcZFP1-R | cggtatcgataagcttATGGCAATTGATGCTTTAGA cgggctgcaggaattcAGCCGGGATTAGGAGCCGG | ||
| 转化植株PCR验证 PCR assay of the transgenic plants | Det-AcZFP1-F Det-AcZFP1-R | CGCAGTACAAGTGCTCCGTA CGGGGCTTCTTGAAAGGGT | ||
| 实时荧光定量PCR Fluorescent quantitative real-time PCR(qRT-PCR) | qAcZFP1-F qAcZFP1-R qAcActin-F qAcActin-R qAtActin-F qAtActin-R qAtKIN1-F qAtKIN1-R qAtKIN2-F qAtKIN2-R qAtCOR47-F qAtCOR47-R qAtRD29A-F qAtRD29A-R | GTGCCACTACGAAGGAACGA GTTTTGCACCCTCAAACCCT CTGGCCTACGTGGCACTTGACTT CACTTCTGGGCAGCGGAACCTTT CCTTCGTCTTGATCTTGCGG AGCGATGGCTGGAACAGAAC ACCAACAAGAATGCCTTCCA CCGCATCCGATACACTCTTT GTCAGAGACCAACAAGAATGCC TGACTCGGATCGCTACTTGTTC CAGTGTCGGAGAGTGTGGTG ACAGCTGGTGAATCCTCTGC GCCGAGAAACTTCAGATTGG CCATTCCTCCTCCTCCTTTC | ||

图2 菠萝 AcZFP1与其他物种中锌指蛋白的序列比对 Ph:矮牵牛;Sl:番茄;Ac:菠萝;Os:水稻;Th:小盐芥。红色框:植物锌指蛋白特有的高度保守序列。
Fig. 2 Protein sequence alignment of AcZFP1 and ZFP proteins in other species Ph:Petunia hybrida;Sl:Solanum lycopersicum;Ac:Ananas comosus;Os:Oryza sativa;Th:Thellungiella halophila. The red box indicates the highly conserved sequences peculiar to zinc finger proteins in plants.
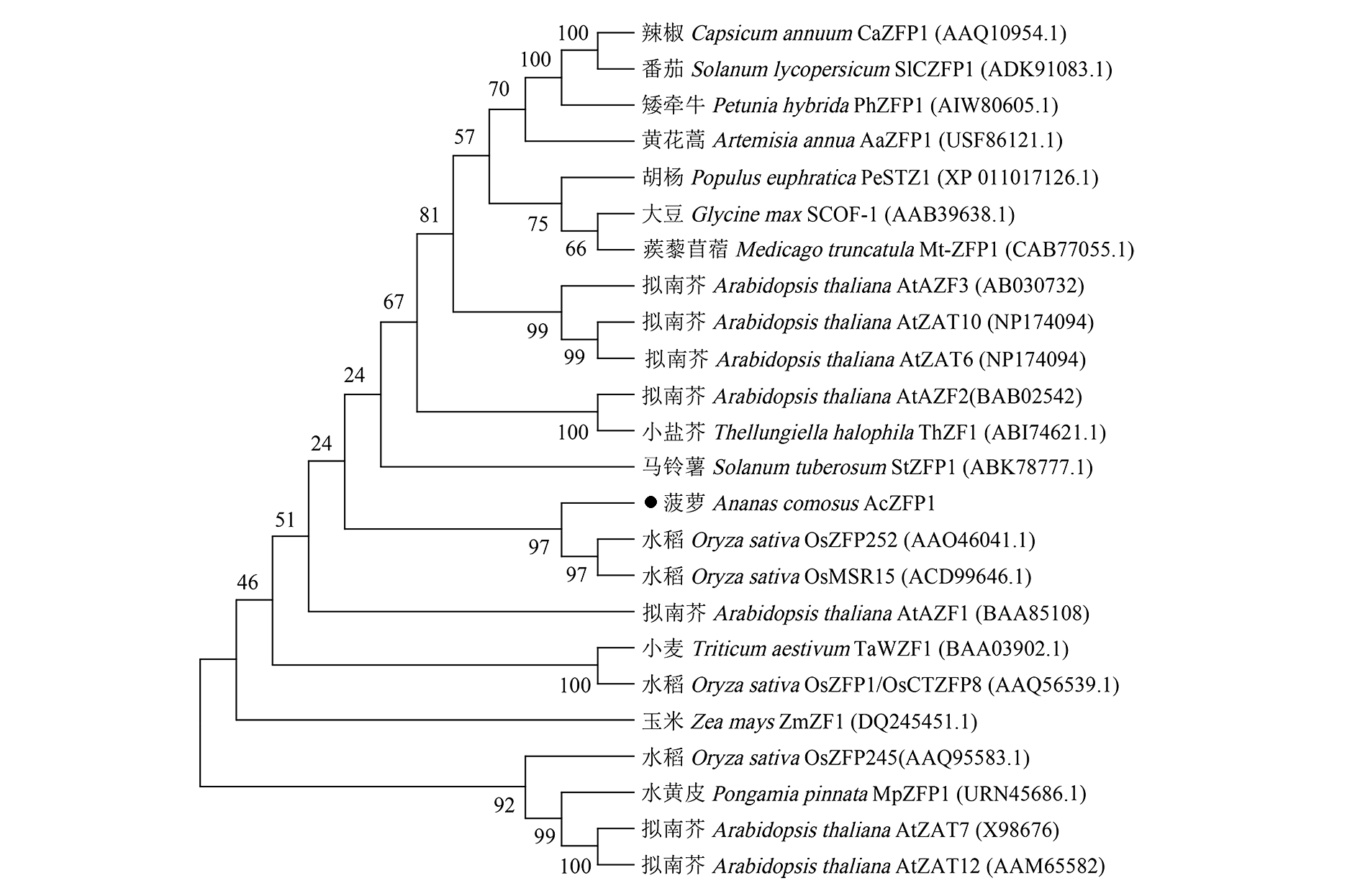
图3 菠萝AcZFP1与其他物种ZFP蛋白系统进化树 进化树节点处的数字代表置信度。
Fig. 3 Phylogenetic tree analysis of pineapple AcZFP1 and ZFP proteins in other plant species Numbers at node represent bootstrap support values.
| 作用元件 Functional element | 序列 Sequence | 位点功能 Function of site | 位置/bp Location |
|---|---|---|---|
| LTRE | CCGAC | 低温响应元件Low temperature responsive element | +627,+194 |
| MBS | CAACTG | 与干旱诱导相关的MYB绑定位点 MYB binding site involved in drought-inducibility | -316 |
| ABRE | ACGTC | 参与ABA响应cis-Acting element involved in the abscisic acid responsiveness | -838,-1 495, +1 366 |
| CGTCA-motif | CGTCA | 参与MeJA响应 cis-Acting element involved in the MeJA-responsiveness | +876,+1509 |
| TGACG-motif | TGACG | 参与MeJA响应cis-Acting element involved in the MeJA-responsiveness | -876,-1 509 |
| P-box | CCTTTTG | 赤霉素应答元件Gibberellin-responsive element | +219,-1 054 |
| SARE | TGACG | 水杨酸响应元件Salicylic acid -responsive promoter element | -881,-1 514 |
| G-box | CACGTG | 参与光响应cis-Acting regulatory element involved in light responsiveness | -1 365 |
| TCT-motif | TCTTAC | 光响应元件的一部分Part of a light responsive element | -722 |
| TCCC-motif | TCTCCCT | 光响应元件的一部分Part of a light responsive element | +1 830,+1 858 |
表2 AcZFP1启动子顺式作用元件
Table 2 Analysis of cis-elments in the promoter of AcZFP1
| 作用元件 Functional element | 序列 Sequence | 位点功能 Function of site | 位置/bp Location |
|---|---|---|---|
| LTRE | CCGAC | 低温响应元件Low temperature responsive element | +627,+194 |
| MBS | CAACTG | 与干旱诱导相关的MYB绑定位点 MYB binding site involved in drought-inducibility | -316 |
| ABRE | ACGTC | 参与ABA响应cis-Acting element involved in the abscisic acid responsiveness | -838,-1 495, +1 366 |
| CGTCA-motif | CGTCA | 参与MeJA响应 cis-Acting element involved in the MeJA-responsiveness | +876,+1509 |
| TGACG-motif | TGACG | 参与MeJA响应cis-Acting element involved in the MeJA-responsiveness | -876,-1 509 |
| P-box | CCTTTTG | 赤霉素应答元件Gibberellin-responsive element | +219,-1 054 |
| SARE | TGACG | 水杨酸响应元件Salicylic acid -responsive promoter element | -881,-1 514 |
| G-box | CACGTG | 参与光响应cis-Acting regulatory element involved in light responsiveness | -1 365 |
| TCT-motif | TCTTAC | 光响应元件的一部分Part of a light responsive element | -722 |
| TCCC-motif | TCTCCCT | 光响应元件的一部分Part of a light responsive element | +1 830,+1 858 |
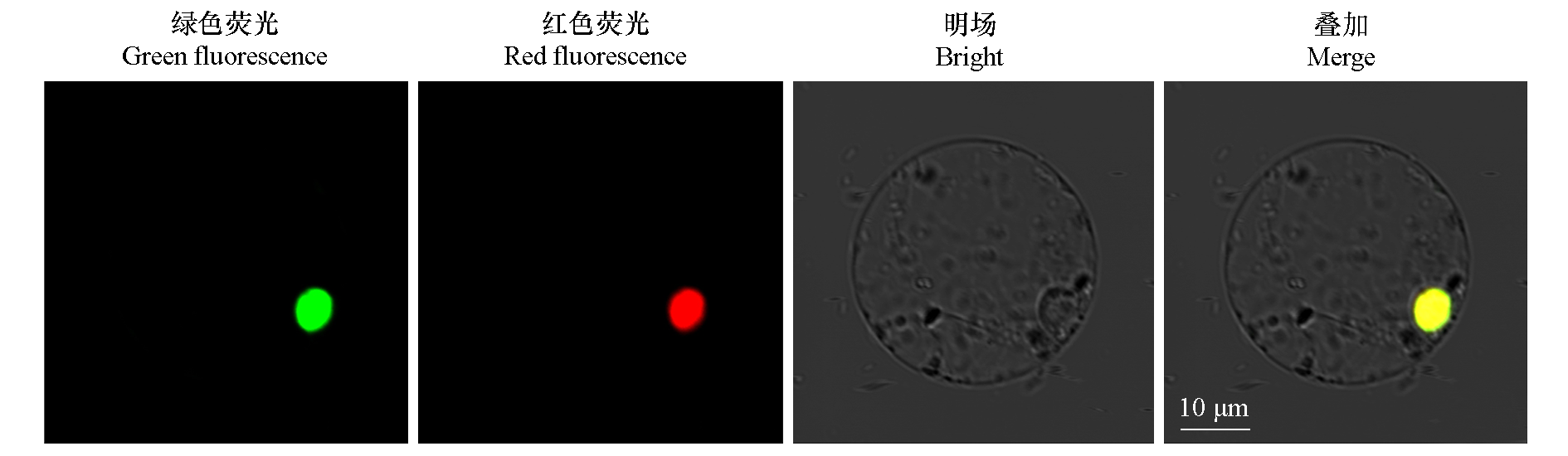
图4 AcZFP1蛋白的亚细胞定位 绿色荧光表示融合蛋白的位置,红色荧光表示细胞核所在位置。若两种荧光信号在同一处,叠加后荧光信号变为黄色。
Fig. 4 The subcellular localization of AcZFP1 The green fluorescence indicates the location of the fusion protein,and the red fluorescence indicates the location of the nucleus. If the two fluorescence signals are in the same place,the fluorescence signal will be yellow after superposition.
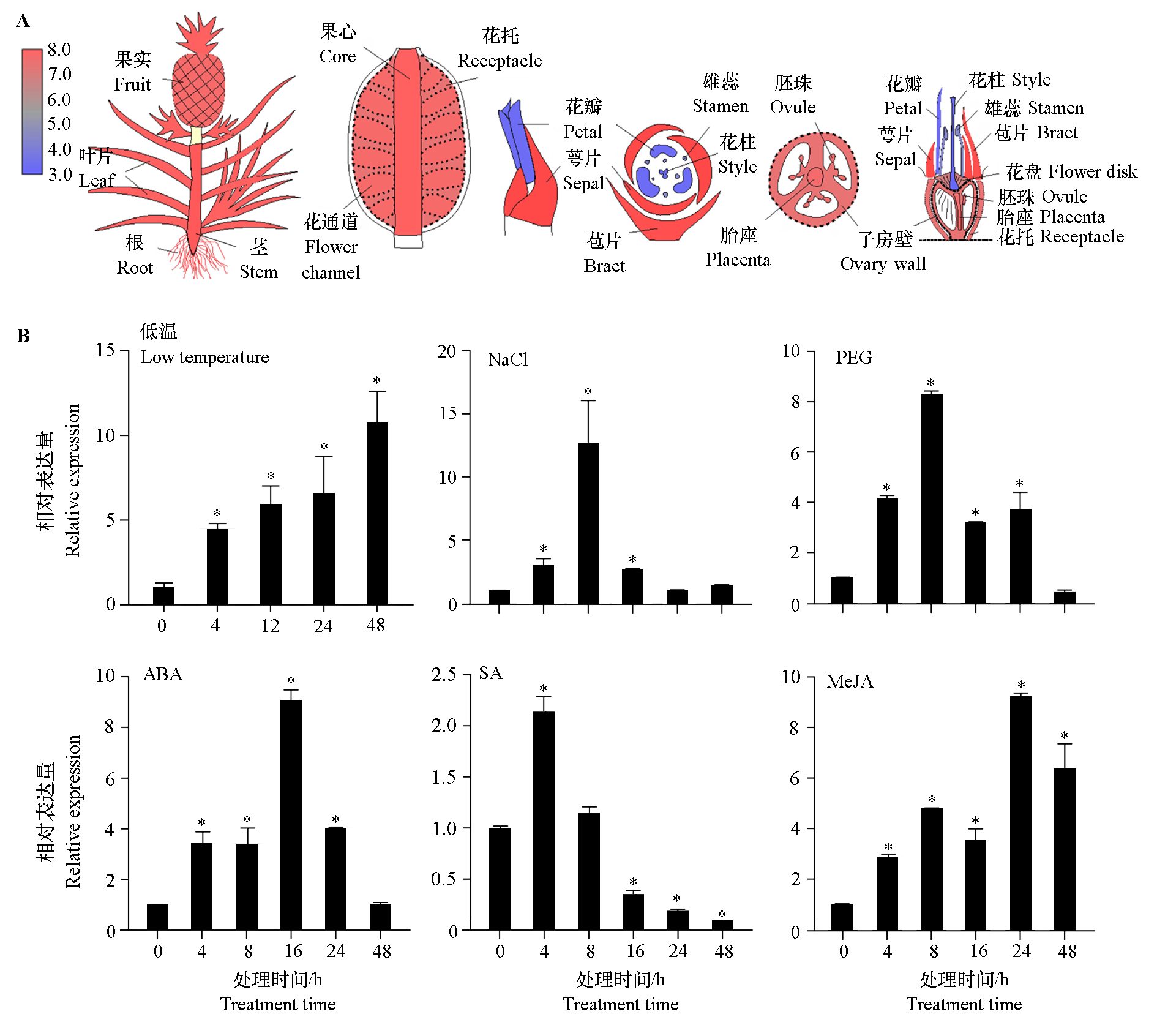
图5 AcZFP1的组织表达(A)和在低温、NaCl、PEG、ABA、SA、MeJA处理下的表达(B) * 表示与对照(0 h)有显著差异(P < 0.05)。
Fig. 5 Expression of AcZFP1 in different tissues(A)and expression under low temperature,NaCl,PEG,ABA,SA and MeJA treated(B) Asterisks indicate significant differences from control(0 h)(P < 0.05).
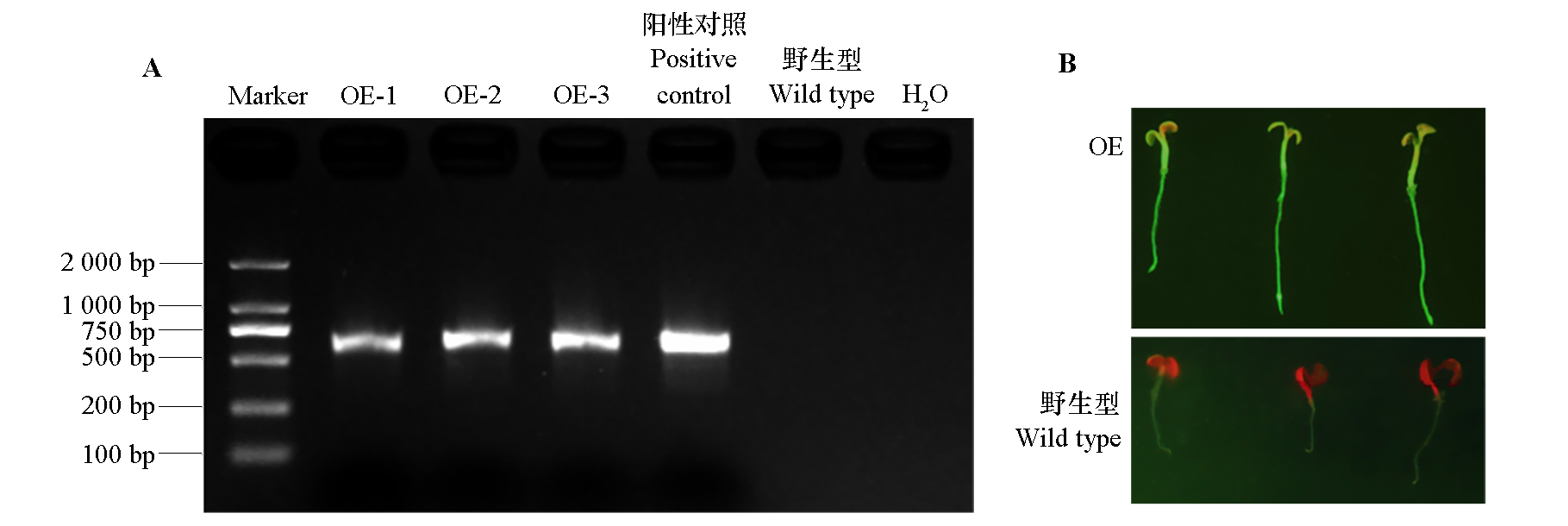
图6 拟南芥过表达AcZFP1株系(OE)PCR验证(A)与绿色荧光蛋白观测(B)
Fig. 6 PCR verification of Arabidopsis thaliana overexpressing AcZFP1(OE)(A)and observation of green fluorescent protein(B)

图7 冷处理条件下拟南芥野生型(WT)和过表达AcZFP1株系(OE)的表型(A)与Fv/Fm叶绿素荧光图像(B)
Fig. 7 Morphological characteristics(A)and Fv/Fm chlorophyll fluorescence image(B)of wild type(WT)and overexpressing AcZFP1 Arabidopsis thaliana lines(OE)under cold treatment

图8 过表达 AcZFP1拟南芥(株系OE)与野生型(WT)在冷处理后的存活情况(A)和Fv/Fm比较(B) * 表示与野生型(WT)有显著差异(P < 0.05)。下同。
Fig. 8 Comparison of survival rate(A)and Fv/Fm(B)in wild type(WT)and overexpressing AcZFP1 Arabidopsis thaliana lines(OE)under cold treatment Asterisks indicate significant differences from wild type(WT)(P < 0.05). The same below.

图9 低温处理条件下野生型(WT)和过表达AcZFP1拟南芥(OE)的POD、SOD活性,可溶性蛋白及MDA含量
Fig. 9 POD and SOD activities,soluble protein and MDA content of wild-type(WT)and overexpressing AcZFP1 Arabidopsis thaliana lines(OE)under low temperature treatment conditions
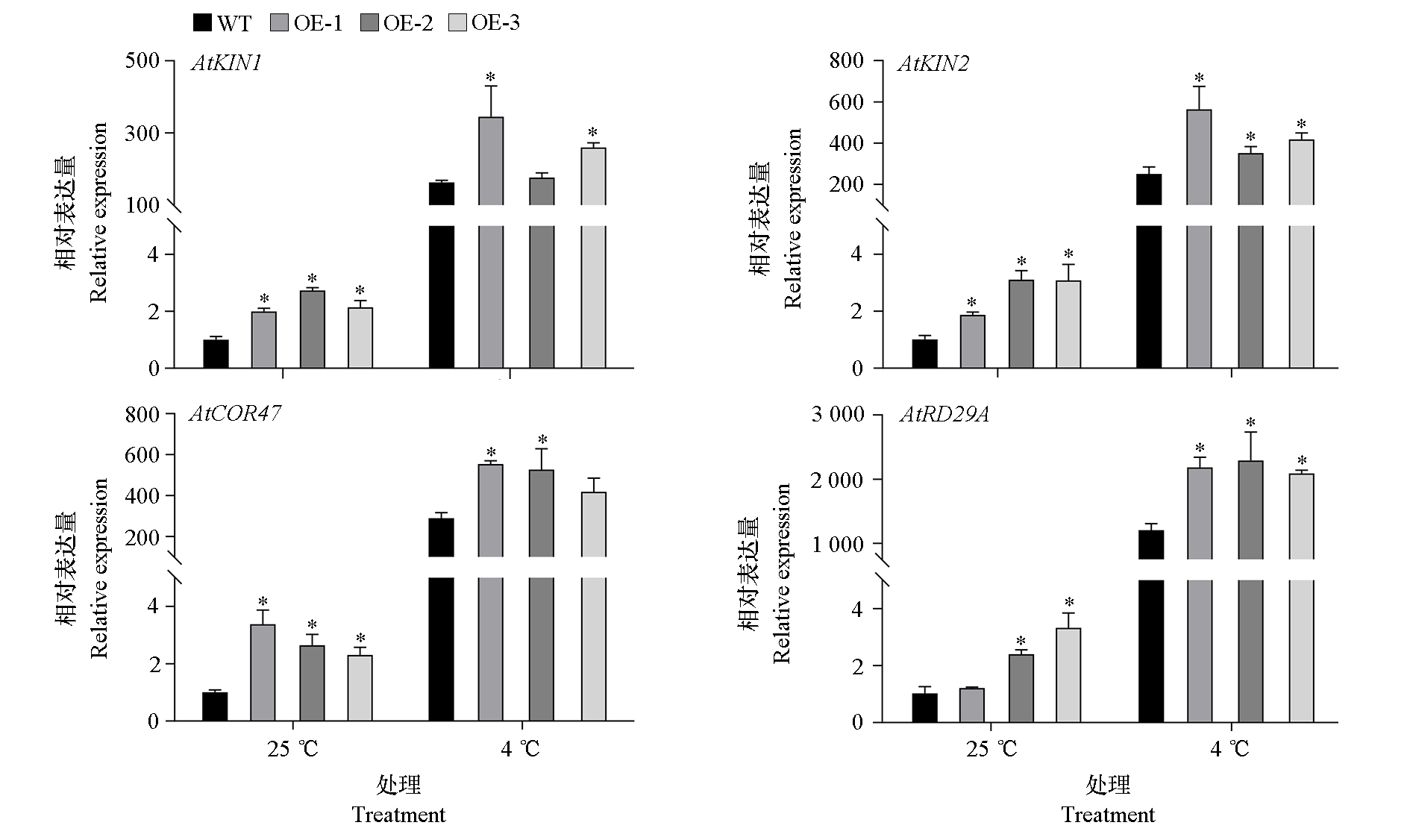
图10 低温处理条件下冷应答相关基因在野生型(WT)和转基因株系(OE)中的表达
Fig. 10 Expression of cold-responsive genes in wild type(WT)and the transgenic lines(OE)under low temperature treatment
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
doi: 10.1007/s00018-007-7473-4 pmid: 18193167 |
| [5] |
|
| [6] |
doi: 10.1111/nph.15696 pmid: 30664232 |
| [7] |
doi: S1674-2052(20)30034-4 pmid: 32068158 |
| [8] |
|
| [9] |
|
| [10] |
doi: 10.1016/j.bbrc.2009.09.032 pmid: 19751706 |
| [11] |
|
| [12] |
|
| [13] |
doi: 10.1046/j.1365-313x.2001.00947.x pmid: 11208017 |
| [14] |
|
|
李可, 申朦晓, 潘炜浩, 章诗渲, 毛欣烨, 尹亚红, 李永强, 朱友银, 郭卫东. 2023. 蓝莓C2H2家族基因在花芽休眠解除中的作用初探. 园艺学报, 50 (4):737-753.
doi: 10.16420/j.issn.0513-353x.2022-0044 |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
|
孙光明. 2019. 中国果树科学与实践 · 菠萝. 西安: 陕西科学技术出版社.
|
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
|
闫明佳. 2019. 苹果锌指蛋白MdZFP2在抗旱、耐寒中的功能研究[硕士论文]. 杨凌: 西北农林科技大学.
|
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
doi: 10.16420/j.issn.0513-353x.2018-0891 |
|
张慧琳, 朱婉, 田丽, 张蔚. 2019. 矮牵牛冷响应转录因子PhZPT2-12的特性及表达分析. 园艺学报, 46 (8):1543-1552.
doi: 10.16420/j.issn.0513-353x.2018-0891 |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
|
钟婵娟, 彭伟业, 王冰, 刘世名, 戴良英, 李魏. 2020. 植物逆境响应相关的C2H2型锌指蛋白研究进展. 植物生理学报, 56 (11):2356-2366.
|
|
| [43] |
|
|
周蕴薇, 刘艳萍, 戴思兰. 2006. 用叶绿素荧光分析技术鉴定植物抗寒性的剖析. 植物生理学通讯, 42 (5):945-950.
|
| [1] | 刘宇香, 韩风庆, 赵鑫雨, 刘玉梅, 李占省, 方智远, . 青花菜侧枝调控基因BoBRC1的克隆及功能分析[J]. 园艺学报, 2024, 51(9): 1997-2007. |
| [2] | 武祥琪, 孙鹂, 俞浙萍, 俞沁佩, 梁森苗, 郑锡良, 戚行江, 张淑文. 杨梅MrSPL4在响应干旱和低温胁迫中的作用研究[J]. 园艺学报, 2024, 51(5): 927-938. |
| [3] | 何业华, 刘朝阳, 栾爱萍, 龚雪, 刘佳柔, 张伟, 林顺权, 胡桂兵, 刘成明, 夏靖娴, 林文秋, 陈程杰, 谢桃, 马均, 何坚驰, 陈少华. 菠萝新品种‘金筒菠萝’[J]. 园艺学报, 2024, 51(2): 453-454. |
| [4] | 冯一清, 仇胜囡, 吴月, 解阳, 张晓伟, 毕焕改, 艾希珍. 褪黑素对日光温室黄瓜耐冷性的影响[J]. 园艺学报, 2024, 51(11): 2633-2644. |
| [5] | 吴 丹, 柳佳欣, 卓林熙, 李 钰, 罗 英, 周 勇, 杨有新, 余 婷, . CaWRKY39在辣椒响应疫霉菌侵染中的功能分析[J]. 园艺学报, 2024, 51(10): 2297-2310. |
| [6] | 刘传和, 贺 涵, 吴夏明, 周陈平, 邝瑞彬, 杨 敏, 魏岳荣. 菠萝新品种‘粤绿煌’[J]. 园艺学报, 2024, 51(10): 2473-2474. |
| [7] | 刘传和, 贺涵, 邵雪花, 赖多, 匡石滋, 肖维强, 刘岩. 菠萝新品种‘粤甜’[J]. 园艺学报, 2023, 50(9): 2059-2060. |
| [8] | 刘慧, 殷向静, 方景浩, 高敏, 李智, 王西平. 中国野生葡萄芪合成酶基因STS19及其启动子的克隆与功能分析[J]. 园艺学报, 2023, 50(7): 1389-1401. |
| [9] | 高鹏飞, 高冰, 冯郑红, 吴建慧. 绢毛委陵菜PsWRKY40的克隆与耐镉功能分析[J]. 园艺学报, 2023, 50(6): 1269-1283. |
| [10] | 王同欢, 吴雨馨, 武艺圆, 李鑫鑫, 刘梦阳, 杨莲莲, 李佳鹏, 张忠山, 曹访, 仲雪婷, 王占旗. 菊花脑GRAS家族鉴定及其低温胁迫响应表达分析[J]. 园艺学报, 2023, 50(4): 815-830. |
| [11] | 俞沁含, 李俊铎, 崔莹, 王佳慧, 郑巧玲, 徐伟荣. 山葡萄转录因子VaMYB4a互作蛋白的筛选与鉴定[J]. 园艺学报, 2023, 50(3): 508-522. |
| [12] | 毛可欣, 安淼, 王海荣, 王世金, 吕巍, 郭盈添, 李健, 李国田. 猕猴桃MYB家族成员鉴定及其低温表达分析[J]. 园艺学报, 2023, 50(3): 534-548. |
| [13] | 任菲, 卢苗苗, 刘吉祥, 陈信立, 刘道凤, 眭顺照, 马婧. 蜡梅胚胎晚期丰富蛋白基因CpLEA的表达及抗性分析[J]. 园艺学报, 2023, 50(2): 359-370. |
| [14] | 吴秀兰, 李桂花, 唐文武. 无籽沙糖橘泛素结合酶E2基因CrUBC2的克隆及功能分析[J]. 园艺学报, 2023, 50(10): 2069-2078. |
| [15] | 殷小雨, 何国仁, 毕蒙蒙, 唐玉超, 郝春莲, 渠雨潇, 郝泽慧, 徐雷锋, 胡凤荣, 杨盼盼, 明军. 卷丹侧生器官边界域基因LlLBD18的克隆和功能分析[J]. 园艺学报, 2023, 50(10): 2117-2127. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||
版权所有 © 2012 《园艺学报》编辑部 京ICP备10030308号-2 国际联网备案号 11010802023439
编辑部地址: 北京市海淀区中关村南大街12号中国农业科学院蔬菜花卉研究所 邮编: 100081
电话: 010-82109523 E-Mail: yuanyixuebao@126.com
技术支持:北京玛格泰克科技发展有限公司